题目内容
14.下列解释实验事实的方程式不正确的是( )| A. | 葡萄糖的酯化反应若用浓硫酸作催化剂会炭化发黑:C6H12O6(葡萄糖)$\stackrel{浓硫酸}{→}$ 6C+6H2O | |
| B. | 向AgNO3溶液中加入过量Na2S溶液后,再加入NaCl溶液,黑色沉淀变成白色:Ag2S+2Cl-=2AgCl↓+S2- | |
| C. | 将NH3通入滴有酚酞的水中,溶液变红:NH3+H2O?NH3•H2O?NH${\;}_{4}^{+}$+OH- | |
| D. | 明矾的水溶液pH<7:Al3++3H2O?Al(OH)3(胶体)+3H+ |
分析 A.浓硫酸具有脱水性,可使葡萄糖碳化而变黑;
B.一般情况下溶解度大的沉淀较易转化成溶解度小的沉淀;
C.常温下,能使酚酞试液变红是碱的通性;
D.明矾中铝离子水解生成氢离子和氢氧化铝,溶液显酸性.
解答 解:A.葡萄糖的酯化反应若用浓硫酸作催化剂,浓硫酸表现脱水性,能将葡萄糖分子中的氢和氧按水的组成脱去,C6H12O6(葡萄糖)$\stackrel{浓硫酸}{→}$6C+6H2O,故A正确;
B.沉淀之所以发生转化是由于添加的离子破坏了原有的沉淀溶解平衡,从而导致沉淀溶解平衡的移动.沉淀转化的方向:一般向着溶解度小的物质方向转化,或者说对于沉淀类型相同的物质,一般向着Ksp减小的方向进行;三种沉淀物的溶解度关系为:AgCl>AgI>Ag2S,所以向AgNO3溶液中加入过量Na2S溶液后,形成Ag2S沉淀,再加NaCl稀溶液,黑色沉淀不会变成白色,故B错误;
C.碱性溶液能使酚酞试液变红,将NH3通入滴加酚酞的水中,NH3+H2O?NH3•H2O?NH4++OH-,呈碱性溶液变成红色,故C正确;
D.明矾溶液中的Al3+属于弱碱阳离子,能水解生成氢离子和氢氧化铝,其离子方程式为:Al3++3H2O?Al(OH)3+3H+,溶液显酸性,pH<7,故D正确;
故选B.
点评 本题考查离子反应方程式的书写,题目难度中等,明确发生的化学反应为解答的关键,涉及浓硫酸的脱水性、沉淀转化的离子反应、电离、水解等知识,综合性较强,注重基础知识的考查.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
4.下列说法正确的是( )
| A. | 蛋白质溶液、淀粉溶液都属胶体 | |
| B. | 碳纤维、纤维素都是有机高分子 | |
| C. | 花生油,牛油互为同分异构体 | |
| D. | 普通玻璃、石英玻璃、水玻璃都是硅酸盐 |
2.下列各组微粒在指定溶液中一定能大量共存的是( )
| A. | 石蕊变红色的溶液:Na+、Mg2+、Cl-、SO42- | |
| B. | 能溶解氧化铝粉末的溶液中:K+、N03-、Cl-、NH4+ | |
| C. | 滴加苯酚溶液显紫色的溶液:NH4+、K+、Cl-、H2S | |
| D. | 由水电离出的c(H+)=10-12mol.L-1的溶液:Na+、K+、NO3-、C6H5O- |
19.下列有关化学用于正确的是( )
| A. | NaHSO4的电离:NaHSO4=Na++H++SO${\;}_{4}^{2-}$ | |
| B. | 葡萄糖的结构简式:C6H12O6 | |
| C. | S2-的结构示意图: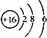 | |
| D. | 质子数为94,中子数为144的钚(Pu)原子:${\;}_{92}^{144}$Pu |
6.阿伏伽德罗常数约为6.02×1023mol-1,下列有关说法正确的是( )
| A. | 1L 0.5mol•L-1 NH4NO3溶液中含氮原子数目6.02×1023 | |
| B. | 标准状况下,22.4L C3H8含有C-H键的数目为6.02×1023 | |
| C. | 32g SO2与足量O2混合充分反应,转移的电子数目为6.02×1023 | |
| D. | 常温下,500mL pH=0的硫酸溶液中含有的H+数目为6.02×1023 |
5.除去溴乙烷中的溴单质,最恰当的试剂是( )
| A. | NaOH溶液 | B. | Na2CO3溶液 | C. | NaHSO3溶液 | D. | KI溶液 |
 .
. 氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.
氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.