题目内容
9.尖晶石型锰酸锂(LiMn2O4)是一种环保绿色能源新型材料,实验室通过下列方法制取:将MnO2和Li2CO3按4:1的物质的量比配料,球磨3~5小时,然后升温至600~750℃,保温24小时,自然冷却到室温得到产品,写出该反应的化学方程式8MnO2+2Li2CO3$\frac{\underline{\;500℃-700℃\;}}{\;}$4LiMn2O4+2CO2↑+O2↑.分析 锰酸锂中没有碳元素,从原子守恒来说,生成物中除了锰酸锂之外,还有其他物质,而且可以肯定是气体物质.题目给出的条件,二氧化锰和碳酸锂物质的量比是4:1,那么锂原子和锰原子个数比为1:2,正好符合锰酸锂中的比例,二氧化锰中锰的化合价为+4,锰酸锂中锰的化合价为+3.5;锰做氧化剂,被还原,所以必定有种元素化合价上升,碳已经是最高价态,所以只能是氧,因为锂和锰完全都在锰酸锂中,所以只能是氧气.
解答 解:MnO2和Li2CO3反应后只有Mn的价态降低,必然有元素的化合价升高,C元素处在最高价态,不能升高,则只能是O元素价态升高,所以还有O2生成.该反应的方程式为:8MnO2+2Li2CO3$\frac{\underline{\;500℃-700℃\;}}{\;}$4LiMn2O4+2CO2↑+O2↑,
故答案为:8MnO2+2Li2CO3$\frac{\underline{\;500℃-700℃\;}}{\;}$4LiMn2O4+2CO2↑+O2↑.
点评 本题考查了化学方程式书写方法,主要是氧化还原反应的分析应用和产物判断,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 实验中要配制500mL 0.2mol•L-1 KCl溶液,需用托盘天平称量7.45gKCl固体 | |
| B. | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 | |
| C. | 排除碱式滴定管尖嘴端气泡时,可以向上弯曲橡皮管,然后挤压玻璃球,排出气泡 | |
| D. | 往含有FeBr2和FeI2的混合溶液中通入足量的氯气,然后把溶液蒸干、灼烧,得到FeCl3固体 |
17.煤矸石是采煤和洗煤时的废弃物,其主要成分是Al2O3、SiO2,另外还含有数量不等的Fe2O3、CaO、MgO、Na2O、K2O、P2O5、SO3和微量稀有元素(如Ga等).下列关于煤矸石的说法正确的是( )
| A. | 可用于生产矸石水泥、耐火砖等建筑材料 | |
| B. | 煤矸石中的金属氧化物均为碱性氧化物 | |
| C. | P2O5和SO3对应水化物的酸性较强的是 H3PO4 | |
| D. | 铝比镓活泼,能电解GaCl3水溶液制备镓单质 |
4.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.相关信息如下表所示,根据推断回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)E在周期表中位于第四周期第IB族,C基态原子核外电子排布式是1s22s22p63s1.
(2)A、B、D三种元素电负性由大到小排列顺序为N>C>Si,其中A的最高价氯化物为非极性分子.(填“极性分子”或“非极性分子”)
(3)A和B的最简单氢化物中沸点较高的NH3.原因是NH3分子间存在氢键.
(4)已知:
①AH4(g)+2BO2(g)=B2(g)+AO2(g)+2H2O(g) H1=-867kJ•mol-1
②2BO2(g)=B2 O4(g) H2=-56.9kJ•mol-1
写出AH4和B2O4反应的热化学方程式CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(g)△H=-810.1kJ/mol.
| A | A的一种单质在自然界中硬度最大 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | 同周期中,C元素的最高价氧化物对应的水化物的碱性最强 |
| D | D的基态原子M层电子数是K层的2 倍 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
(2)A、B、D三种元素电负性由大到小排列顺序为N>C>Si,其中A的最高价氯化物为非极性分子.(填“极性分子”或“非极性分子”)
(3)A和B的最简单氢化物中沸点较高的NH3.原因是NH3分子间存在氢键.
(4)已知:
①AH4(g)+2BO2(g)=B2(g)+AO2(g)+2H2O(g) H1=-867kJ•mol-1
②2BO2(g)=B2 O4(g) H2=-56.9kJ•mol-1
写出AH4和B2O4反应的热化学方程式CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(g)△H=-810.1kJ/mol.
14.下列解释实验事实的方程式不正确的是( )
| A. | 葡萄糖的酯化反应若用浓硫酸作催化剂会炭化发黑:C6H12O6(葡萄糖)$\stackrel{浓硫酸}{→}$ 6C+6H2O | |
| B. | 向AgNO3溶液中加入过量Na2S溶液后,再加入NaCl溶液,黑色沉淀变成白色:Ag2S+2Cl-=2AgCl↓+S2- | |
| C. | 将NH3通入滴有酚酞的水中,溶液变红:NH3+H2O?NH3•H2O?NH${\;}_{4}^{+}$+OH- | |
| D. | 明矾的水溶液pH<7:Al3++3H2O?Al(OH)3(胶体)+3H+ |
18.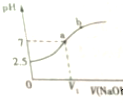 常温下,在10mL 0.1mol•L-1 NaHSO3溶液中逐滴滴加0.1mol•L-1 NaOH溶液,反应过程中溶液pH变化如图所示,下列说法不正确的是( )
常温下,在10mL 0.1mol•L-1 NaHSO3溶液中逐滴滴加0.1mol•L-1 NaOH溶液,反应过程中溶液pH变化如图所示,下列说法不正确的是( )
 常温下,在10mL 0.1mol•L-1 NaHSO3溶液中逐滴滴加0.1mol•L-1 NaOH溶液,反应过程中溶液pH变化如图所示,下列说法不正确的是( )
常温下,在10mL 0.1mol•L-1 NaHSO3溶液中逐滴滴加0.1mol•L-1 NaOH溶液,反应过程中溶液pH变化如图所示,下列说法不正确的是( )| A. | NaHSO3溶液呈酸性 | B. | V1<10mL | ||
| C. | 在a点,c(Na+)=c(SO32- )+c(HSO3-) | D. | HSO3-的电离常数Ka=6.25×10-7 |