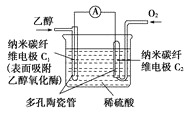
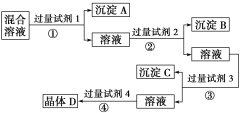
题目内容
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2 p1>p2 m+n>p 放热反应B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应D.T1>T2 p1<p2 m+n<p 吸热反应
【答案】D
【解析】
定压强相同,比较温度不同时,即比较曲线T1、p2与曲线T2、p2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的温度高,所以T1>T2,由图知温度越高,B的含量越低,所以平衡向正反应进行,升高温度,平衡向吸热方向移动,故正反应为吸热反应;
定温度相同,比较压强不同时,即比较曲线T1、p1与曲线T1、p2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的压强高,所以p1<p2,由图知压强越大,B的含量越高,所以平衡向逆反应进行,增大压强,平衡向体积减小的方向移动,所以m+n<p;
根据以上分析得出:T1>T2,反应吸热;p1<p2,m+n<p;D项正确,
答案选D。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】已知:AlO+HCO+H2O=Al(OH)3↓+CO![]() ,向含0.01 mol NaAlO2和0.02mol NaOH的稀溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,下列对应关系正确的是( )
,向含0.01 mol NaAlO2和0.02mol NaOH的稀溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,下列对应关系正确的是( )
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2—)>c(OH) |
B | 0.01 | c(CO32—)+c(HCO3—)+c(H2CO3)=c(AlO2—) |
C | 0.015 | c(Na+)>c(CO32—)>c(OH)>c(HCO3—) |
D | 0.03 | c(Na+)+c(H+)=c(CO32—)+c(HCO3—)+c(OH) |
A.AB.BC.CD.D