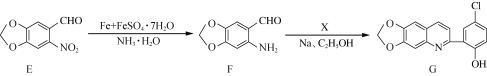
题目内容
【题目】已知甲为恒压容器、乙为恒容容器相同条件下充入等物质的量的![]() 气体,且起始时体积相同,发生反应:2NO2(g)
气体,且起始时体积相同,发生反应:2NO2(g)![]() N2O4(g) H <0 一段时间后相继达到平衡状态下列说法中正确的是( )
N2O4(g) H <0 一段时间后相继达到平衡状态下列说法中正确的是( )
A. 平衡时![]() 体积分数:甲<乙
体积分数:甲<乙
B. 达到平衡所需时间,甲与乙相等
C. 该反应的平衡常数表达式K=![]()
D. 若两容器内气体的压强保持不变,均说明反应已达到平衡状态
【答案】A
【解析】
A、反应起始时,二氧化氮的浓度相同、温度相同、压强相同,反应速率相同,随反应进行,容器乙中压强降低,容器甲体积可变,压强不变,故反应达到平衡时,两容器内的压强关系是p(甲)>p(乙),甲中平衡正向进行,平衡时NO2体积分数减小,甲<乙,所以A选项是正确的;
B、容器乙体积不变,随反应进行,反应混合气体的物质的量减小,容器乙中压强降低,容器甲体积可变,压强不变,压强越大,反应速率越快,达到平衡所需时间甲短,故B错误;
C、平衡常数应等于生成物浓度系数次幂之积除以反应物浓度系数次幂之积,即平衡常数K=![]() ,故C错误;
,故C错误;
D、容器乙体积不变,随反应进行,反应混合气体的物质的量减小,容器乙中压强降低,容器甲体积可变,压强不变,故反应达到平衡时,两容器内的压强关系是p(甲)>p(乙),甲容器始终不变,故D错误。
所以A选项是正确的。

 全优考典单元检测卷及归类总复习系列答案
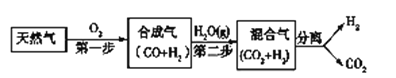
全优考典单元检测卷及归类总复习系列答案【题目】I. 科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示部分(条件及物质未标出)。
(1)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
P后/P前 | 0.9 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
用H2 表示前2 h平均反应速率v(H2) =__________ mol·(L·h)-1。
(2)在300 ℃、8 MPa下,将二氧化碳和氢气按物质的量之比为1∶3通入一密闭容器中发生(1)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp= ________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
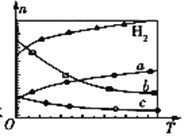
①该反应的ΔH ______ 0 (填“>”、“=”或“<”)。
②曲线c表示的物质为 ____________________。
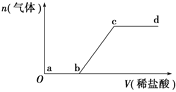
II. 砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。某小组欲探究可逆反应AsO33-+I2+2OH- ![]() AsO43- + 2I- + H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L的盐酸,发现又产生电流,实验中电流与时的关系如图II所示。
AsO43- + 2I- + H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L的盐酸,发现又产生电流,实验中电流与时的关系如图II所示。
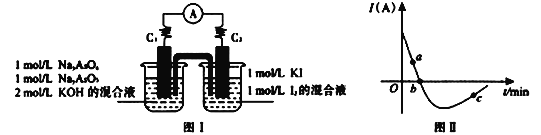
(1)图II中AsO43-的逆反应速率:a____b( 填“>”、“<”或“=” )。
(2)写出图II中c点对应图I装置的正极反应式__________________________。
(3)能判断该反应达到平衡状态的是________。
a.2v(I-)正=v(AsO33-)逆b.溶液的pH不再变化
c.电流表示数变为零 d.溶液颜色不再变化