题目内容
【题目】I. 科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示部分(条件及物质未标出)。
(1)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
P后/P前 | 0.9 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
用H2 表示前2 h平均反应速率v(H2) =__________ mol·(L·h)-1。
(2)在300 ℃、8 MPa下,将二氧化碳和氢气按物质的量之比为1∶3通入一密闭容器中发生(1)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp= ________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
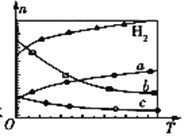
①该反应的ΔH ______ 0 (填“>”、“=”或“<”)。
②曲线c表示的物质为 ____________________。
II. 砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。某小组欲探究可逆反应AsO33-+I2+2OH- ![]() AsO43- + 2I- + H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L的盐酸,发现又产生电流,实验中电流与时的关系如图II所示。
AsO43- + 2I- + H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L的盐酸,发现又产生电流,实验中电流与时的关系如图II所示。
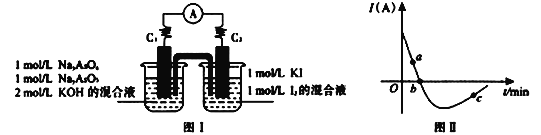
(1)图II中AsO43-的逆反应速率:a____b( 填“>”、“<”或“=” )。
(2)写出图II中c点对应图I装置的正极反应式__________________________。
(3)能判断该反应达到平衡状态的是________。
a.2v(I-)正=v(AsO33-)逆b.溶液的pH不再变化
c.电流表示数变为零 d.溶液颜色不再变化
【答案】0.225 ![]() MPa-2(或0.021MPa-2) < C2H4 < AsO43-+2e-+2H+=AsO33-+H2O bcd
MPa-2(或0.021MPa-2) < C2H4 < AsO43-+2e-+2H+=AsO33-+H2O bcd
【解析】
I. (1)列出三段式,找出浓度变化量,再根据v(H2)=![]() 计算;
计算;
(2) 列出三段式,找出CO2、H2、CH3OH、H2O的分压,再根据v(H2)=Kp=![]() 计算;
计算;
(3)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,ΔH<0。
②随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线a代表CO2,由计量数关系可知曲线b代表水,曲线c代表C2H4。
II. (1)随着反应的进行,离子浓度减小,电流减小,正反应速率减小,逆反应速率增大,故图II中AsO43-的逆反应速率:a<b;
(2)图II中c点酸性条件下对应图I装置的正极AsO43-得电子产生AsO33-;
(3)a.根据速率关系,v(I-)正=2v(AsO33-)逆 ,则等式始终成立,反应不一定处于平衡状态;b.溶液的pH不再变化,则氢氧根离子浓度也保持不变,反应处于平衡状态;
c.电流表示数变为零则氧化还原反应中电子转移不再增减,反应物的浓度保持不变,反应处于平衡状态;
d.溶液颜色不再变化,则碘单质的浓度保持不变,反应处于平衡状态;
I. (1)由反应前后的压强关系可知2 h时,体系中气体的总的物质的量为4mol![]() 0.85=3.4 mol,减少了0.6 mol。
0.85=3.4 mol,减少了0.6 mol。
CO2(g) + 3H2(g)![]() CH3OH(g)+ H2O(g) Δn(减少)
CH3OH(g)+ H2O(g) Δn(减少)
起始(mol) 1 3 0 0 2
变化(mol) 0.3 0.9 0.3 0.3 0.6
2h末(mol) 0.7 2.1 0.3 0.3
v(H2)=![]() =
=![]() =0.225 mol·L-1·h-1。
=0.225 mol·L-1·h-1。
因此,本题正确答案是:0.225;
(2)设开始时投入CO2和H2的物质的量分别为1 mol和3 mol。
CO2(g) + 3H2(g)![]() CH3OH(g)+ H2O(g)
CH3OH(g)+ H2O(g)
起始(mol) 1 3 0 0
变化(mol) 0.5 1.5 0.5 0.5
平衡(mol) 0.5 1.5 0.5 0.5
则平衡时
p(CO2)=8 MPa×![]() =4/3 MPa, p(H2)=8 MPa×
=4/3 MPa, p(H2)=8 MPa×![]() =4 MPa,p(CH3OH)=8 MPa×
=4 MPa,p(CH3OH)=8 MPa×![]() =4/3 MPa,p(H2O)=8 MPa×
=4/3 MPa,p(H2O)=8 MPa×![]() =4/3 MPa,Kp=
=4/3 MPa,Kp=![]() =
=![]() =
=![]() ≈0.021(MPa-2)。
≈0.021(MPa-2)。
因此,本题正确答案是:![]() MPa-2(或0.021MPa-2);
MPa-2(或0.021MPa-2);
(3)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,ΔH<0。
②随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线a代表CO2,由计量数关系可知曲线b代表水,曲线c代表C2H4。
因此,本题正确答案是:<;C2H4;
II. (1)随着反应的进行,离子浓度减小,电流减小,正反应速率减小,逆反应速率增大,故图II中AsO43-的逆反应速率:a<b;
因此,本题正确答案是:<;
(2)图II中c点酸性条件下对应图I装置的正极AsO43-得电子产生AsO33-,电极反应式为AsO43-+2e-+2H+= AsO33-+H2O;
因此,本题正确答案是:AsO43-+2e-+2H+=AsO33-+H2O;
(3)a.根据速率关系,v(I-)正=2v(AsO33-)逆 ,则等式始终成立,反应不一定处于平衡状态;b.溶液的pH不再变化,则氢氧根离子浓度也保持不变,反应处于平衡状态;
c.电流表示数变为零,则氧化还原反应的正反应速率与逆反应速率相等,反应物的浓度保持不变,反应处于平衡状态;
d.溶液颜色不再变化,则碘单质的浓度保持不变,反应处于平衡状态;
因此,本题正确答案是:bcd。

【题目】下列实验操作与预期实验目的或所得实验结论不一致的是( )
选项 | 实验操作 | 实验目的或结论 |
A、 |
| 通过观察液面差判断该装置的气密性 |
B、 | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
C、 | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗涤的沉淀中加稀盐酸,有气泡产生 | 说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
D、 | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | 不能检验制得气体是否为乙烯 |
A. AB. BC. CD. D