题目内容
【题目】17.4g MnO2与240 mL 10 mol/L(密度为1.10g/mL)的盐酸(足量)混合加热(不考虑盐酸挥发),使其充分反应后,再向溶液中加入足量的AgNO3溶液。(已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O)
MnCl2+Cl2↑+2H2O)
试求:(1)10 mol/L的盐酸的质量分数____________
(2)产生的气体在标准状况下的体积______________;
(3)产生沉淀的质量_________________。
【答案】33.2% 4.48L 287g
【解析】
(1)根据c=![]() 计算溶液的质量分数;
计算溶液的质量分数;
(2)先计算MnO2、HCl的物质的量,判断哪种物质过量,以不足量的物质为标准计算Cl2的物质的量及体积;
(3)根据Cl元素守恒,计算反应产生的AgCl沉淀的物质的量,然后根据m=n·M计算质量。
(1)根据c=![]() 可知该溶液的质量分数为
可知该溶液的质量分数为![]() =33.2%;
=33.2%;
(2)n(MnO2)=m÷M=17.4g÷87g/mol=0.2mol,n(HCl)=0.24L×10mol/L=2.4mol,n(MnO2):n(HCl)=0.2mol:2.4mol=1:12,根据反应方程式MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O可知二者反应的物质的量的比是1:4,可见浓盐酸过量,反应产生Cl2要以MnO2为标准,n(Cl2)= n(MnO2)=0.2mol,所以产生的气体在标准状况下的体积V(Cl2)=0.2mol×22.4L/mol=4.48L;
MnCl2+Cl2↑+2H2O可知二者反应的物质的量的比是1:4,可见浓盐酸过量,反应产生Cl2要以MnO2为标准,n(Cl2)= n(MnO2)=0.2mol,所以产生的气体在标准状况下的体积V(Cl2)=0.2mol×22.4L/mol=4.48L;
(3)反应反应后溶液中含有Cl-的物质的量为n(Cl-)=2.4mol-2×0.2mol=2mol,向反应后的溶液中加入足量的AgNO3溶液,发生反应Ag++Cl-=AgCl↓,则反应产生沉淀的质量n(AgCl)= n(Cl-)=2mol,则m(AgCl)=2mol×143.5g/mol=287g。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案【题目】下列实验操作与预期实验目的或所得实验结论不一致的是( )
选项 | 实验操作 | 实验目的或结论 |
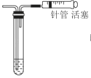
A、 |
| 通过观察液面差判断该装置的气密性 |
B、 | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
C、 | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗涤的沉淀中加稀盐酸,有气泡产生 | 说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
D、 | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | 不能检验制得气体是否为乙烯 |
A. AB. BC. CD. D