题目内容
【题目】已知反应3BrF3 + 5H2O = Br2 + HBrO3 + O2↑ + 9HF,当生成3 mol Br2时,被水还原的BrF3的物质的量为
A.9 molB.6 molC.4 molD.2 mol
【答案】C
【解析】
3BrF3 + 5H2O = Br2 + HBrO3 + O2↑ + 9HF中,Br元素化合价由+3价变为+5价、-1价,部分O元素化合价由-2价变为0价,该反应中有2mol水作还原剂,根据转移电子守恒计算被水还原的BrF3的物质的量。
3BrF3 + 5H2O =Br2 + HBrO3 + O2↑ + 9HF中,Br 元素化合价由+3价变为+5价、- 1价,部分O元素化合价由- 2价变为0价,该反应中有5mol水作还原剂,水失去电子的物质的量= 5mol×(2- 0)= 10mol,根据转移
电子守恒得被水还原的BrF3的物质的量![]() ,所以若有
,所以若有![]() 水发生氧化反应,则被水还原的BrF3的物质的量为
水发生氧化反应,则被水还原的BrF3的物质的量为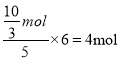 ,
,
故选C。

练习册系列答案
相关题目
【题目】下列实验操作与预期实验目的或所得实验结论不一致的是( )
选项 | 实验操作 | 实验目的或结论 |
A、 |
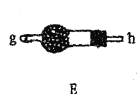
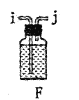
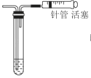
| 通过观察液面差判断该装置的气密性 |
B、 | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
C、 | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗涤的沉淀中加稀盐酸,有气泡产生 | 说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
D、 | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | 不能检验制得气体是否为乙烯 |
A. AB. BC. CD. D