题目内容
10.人体葡萄糖代谢的复杂过程,在化学上常简化为葡萄糖的氧化:C6H12O6+6O2$\frac{\underline{\;酶\;}}{\;}$6CO2+6H2O.1mol葡萄糖完全氧化放出2880kJ热量,若一个人摄入10g葡萄糖,这些葡萄糖最多能提供多少能量?人需吸收多少升空气(标准状况下)?分析 根据n=$\frac{m}{M}$计算10g葡萄糖的物质的量,结合1mol葡萄糖完全氧化放出的热量计算10g葡萄糖完全氧化提供的能量;根据方程式计算需要氧气的体积,再结合空气中氧气体积分数计算需要空气的体积.
解答 解:10g葡萄糖的物质的量为$\frac{10g}{180g/mol}$=$\frac{1}{18}$mol,故其完全氧化提供能量为:2880kJ×$\frac{\frac{1}{18}mol}{1mol}$=160kJ;
设需要氧气的体积为V,则:
C6H12O6+6O2$\frac{\underline{\;酶\;}}{\;}$6CO2+6H2O
180g 6×22.4L
10g V
所以V=$\frac{10g×6×22.4L}{180g}$=7.47L,
故需要空气的体积为7.47L÷20%=37.25L,
答:10g葡萄糖最多能提供160kJ能量,人需吸收37.25升空气.
点评 本题考查反应热计算、化学方程式计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
20.不能用磨口玻璃塞的试剂瓶盛装的溶液是( )
| A. | NaOH溶液 | B. | CuSO4溶液 | C. | AgNO3溶液 | D. | Na2SiO3溶液 |
1.0.1 mol•L-1的CH3COONH4溶液显中性,下列关于该溶液的说法正确的是 ( )
| A. | 该溶液中:c(CH3COO-)=c(NH4+)=0.1 mol•L-1 | |
| B. | 该溶液中:c(CH3C00H)=c(NH3•H20)=c(H+)=c(OH- ) | |
| C. | 该溶液中:c(CH3COOH)-c(OH-)=c(NH3.H20)-c(H+) | |
| D. | 该溶液中:c(CH3COO-)+c(CH3C00H)=c(NH3.H20)+c(NH4+)=0.4mol•L-1 |
18. 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )| A. | 充电时,电极A接电源的正极 | |
| B. | 充电时,电极B的反应式为Sx2--2e-═xS | |
| C. | 放电时,电极B为负极,Na+由A向B移动 | |
| D. | 放电时,负极反应式为2Na-2e-═2Na+ |
4.下列关于化学的叙述中,错误的是( )
| A. | 在化工生产中应遵循“绿色化学”的思想 | |
| B. | 通常用来衡量一个国家的石油化学工业发展水平的标志是乙烯的产量 | |
| C. | 在元素周期表的金属和非金属分界线附近寻找半导体材料 | |
| D. | 根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4 |
5.化合物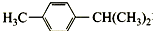 在核磁共振氢谱图中各信号的面积比为( )
在核磁共振氢谱图中各信号的面积比为( )
 在核磁共振氢谱图中各信号的面积比为( )
在核磁共振氢谱图中各信号的面积比为( )| A. | 3:4:1:3:3 | B. | 3:2:2:1:6 | C. | 9:4:1 | D. | 3:4:7 |