题目内容
9.在一定条件下,对于密闭容器中进行的反应2SO2(g)+O2(g)?2SO3(g),下列说法中能说明该反应已经达到化学平衡状态的是( )| A. | SO2、O2、SO3的体积分数不再改变 | |
| B. | 反应停止 | |
| C. | SO2、O2、SO3的物质的量之比为2:1:2 | |
| D. | 消耗SO2的速率与生成SO3的速率相等 |
分析 在一定条件下,对于密闭容器中进行的反应2SO2(g)+O2(g)?2SO3(g),达到化学平衡状态,正逆反应速率相等,各组分的浓度不会变化,据此进行判断.
解答 解:A、SO2、O2、SO3的体积分数不再改变,说明物质的量浓度不再改变,正逆反应速率相同,达到平衡状态,故A正确;
B、达到平衡状态,即正逆反应速率相同,不是反应停止,化学平衡是动态的平衡,故B错误;
C、各组分的物质的量之比,无法判断各组分的物质的量是否变化,正逆反应速率是否相等,无法判断是否达到平衡状态,故C错误;
D、消耗SO2的速率与生成SO3的速率相等,表示的是都是正反应速率,无法判断正逆反应速率是否相等,故D错误;
故选A.
点评 本题考查了化学平衡状态的判断,根据达到平衡状态,各组分的浓度不变,正逆反应速率相等进行判断即可,本题难度不大.

| A. | NO与O2反应 | B. | 碘加热升华 | C. | 氯酸钾加热分解 | D. | 氯化钠溶于水 |
| A. | 酸性强弱:HIO4>HBrO4 | B. | 原子半径大小 Na>S>O | ||
| C. | 碱性强弱KOH>NaOH | D. | 金属性强弱Na>Mg>Al |
| A. | 加入催化剂能加快NH3转化为NO | |
| B. | 加压有利于N2与H2反应生成NH3 | |
| C. | 往醋酸溶液中加少量碱,有利于CH3COO-的增多 | |
| D. | 配制FeCl3溶液时,向溶液中加入少量盐酸 |
| A. | 3-甲基丁烷 | B. | 3-甲基-2-乙基戊烷 | ||
| C. | 2-乙基丙烷 | D. | 2,4-二甲基戊烷 |
| A. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| B. | 向氯水中加CaCO3后,溶液漂白性增强 | |
| C. | 将氯化铁溶液加热蒸干最终得不到氯化铁固体 | |
| D. | 增大压强,有利于SO2和O2反应生成SO3 |
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒 容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)
容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g) 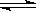 2NH3(g)
2NH3(g) 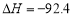 kJ·mol
kJ·mol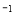 )
)
容器 | 甲 | 乙 | 丙 |
| 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
NH3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
体系压强(pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
请写出下列物理量的关系:
(1)浓度c1与c2_________________;2c2与c3________________
(2)能量a与b __________________;2b与c___________________
(3)压强p1与p2_________________;2p2与p3__________________
(4)转化率α1与α2________________;α2与α3___________________
 反应物投入量
反应物投入量