题目内容
4.(1)把表面已锈蚀的铁片放入稀盐酸中,有气泡产生,充分反应后,铁片有剩余,则溶液中所发生化学反应的方程式有Fe2O3+6HCl=2FeCl3+3H2O、Fe+2HCl=FeCl2+H2↑、Fe+2FeCl3=3FeCl2;(2)往浅绿色的Fe(NO3)2溶液中,逐滴加入稀盐酸时,溶液的颜色变化应是由浅绿色变为棕色,此反应的还原剂是Fe2+,它的氧化产物是Fe3+.由此可知,酸性条件下NO3-的氧化性>(填“>”“=”或“<”)Fe3+的氧化性.
分析 (1)把生锈的铁钉放到足量的稀盐酸中,表面的铁锈先与盐酸反应,当铁锈反应完后,铁继续与盐酸反应,据此回答问题即可;
(2)酸性条件下硝酸根离子具有强氧化性,能将亚铁离子氧化为三价,二价铁浅绿色,三价铁为棕黄色,根据氧化还原反应来分析氧化剂和还原剂.
解答 解:(1)生锈的铁钉插入足量的稀盐酸中,铁锈与盐酸反应,生成氯化铁与水:Fe2O3+6HCl=2FeCl3+3H2O;铁锈反应完后露出铁钉,铁钉与盐酸反应,生成氢气:Fe+2HCl=FeCl2+H2↑;由于铁片有剩余,故过量的铁片还能与氯化铁反应:Fe+2FeCl3=3FeCl2.
故答案为:Fe2O3+6HCl=2FeCl3+3H2O、Fe+2HCl=FeCl2+H2↑、Fe+2FeCl3=3FeCl2;
(2)往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸时,发生反应的离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H20,三价铁离子为棕黄色,即颜色由浅绿色变为棕黄色;在氧化还原反应中,化合价升高被氧化的是还原剂,得到的是氧化产物,故还原剂为Fe2+,氧化产物为 Fe3+,由于氧化还原反应中,氧化剂的氧化性大于氧化产物,故酸性条件下NO3-的氧化性大于Fe3+的氧化性.
故答案为:由浅绿色变为棕色;Fe2+;Fe3+;>.
点评 本题考查了不同价态铁之间的转化,为高频考点,侧重于学生的分析能力的考查,题目难度不大,明确硝酸根离子在酸性环境下具有强的氧化性是解题关键,熟记常见金属阳离子的颜色和氧化还原反应中角色的判断.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
12.通常状况下,能共存且能用浓硫酸干燥的一组气体是( )
| A. | H2、CO2、N2 | B. | H2、N2、NH3 | C. | NH3、HCl、NO2 | D. | NO、O2、CO2 |
19.下列离子方程式书写正确的是( )
| A. | 金属铝溶于氢氧化钠溶液中:Al+2OH-=AlO2-+H2↑ | |
| B. | 铜与稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| C. | 硫酸铵溶液与氢氧化钡溶液反应:NH4++OH-=NH3↑+H2O | |
| D. | 铁与稀硝酸反应:Fe+2H+=Fe2++H2↑ |
9.在一定条件下,对于密闭容器中进行的反应2SO2(g)+O2(g)?2SO3(g),下列说法中能说明该反应已经达到化学平衡状态的是( )
| A. | SO2、O2、SO3的体积分数不再改变 | |
| B. | 反应停止 | |
| C. | SO2、O2、SO3的物质的量之比为2:1:2 | |
| D. | 消耗SO2的速率与生成SO3的速率相等 |
16.下列说法中错误的是( )
| A. | 升高温度能使FeCl3溶液中的H+浓度增大 | |
| B. | 在室温下能自发进行的反应,其△H一定小于0 | |
| C. | 溶液呈中性的盐不一定是强酸和强碱生成的盐 | |
| D. | 常温下,0.005mol•L-1Ba(OH)2溶液pH为12 |
13.下列有关化学键的叙述,不正确的是( )
| A. | 单质分子中可能不含化学键 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | 含有极性键的分子一定是极性分子 | |
| D. | 含有共价键的化合物不一定是共价化合物 |
12.强酸和强碱在稀溶液中的中和热可表示为:
H+(aq)+OH-(aq)=H2O(l);△H=-57.3k kJ•mol-1,
又知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H=-Q1kJ•mol-1,
$\frac{1}{2}$H2SO4(浓)+$\frac{1}{2}$Ba(OH)2(aq)=$\frac{1}{2}$BaSO4(aq)+H2O(l);△H=-Q2 kJ•mol-1
HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(l);△H=-Q3 kJ•mol-1,
上述反应均为溶液中的反应,则Q1、Q2、Q3的大小关系是( )
H+(aq)+OH-(aq)=H2O(l);△H=-57.3k kJ•mol-1,
又知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H=-Q1kJ•mol-1,
$\frac{1}{2}$H2SO4(浓)+$\frac{1}{2}$Ba(OH)2(aq)=$\frac{1}{2}$BaSO4(aq)+H2O(l);△H=-Q2 kJ•mol-1
HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(l);△H=-Q3 kJ•mol-1,
上述反应均为溶液中的反应,则Q1、Q2、Q3的大小关系是( )
| A. | Q2>Q3>Q1 | B. | Q2>Q1>Q3 | C. | Q1=Q2=Q3 | D. | Q2=Q3>Q1 |
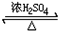 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.