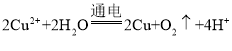题目内容
【题目】现有 A、B、C、D、E、F 六种短周期主族元素,其相关性质信息如下:
元素 | 相关信息 |
A | 地壳中含量最多的金属元素 |
B | 原子核外电子数和周期序数相等 |
C | 最外层电子数是次外层电子数的 3 倍 |
D | 最高正价与最低负价代数和为 4,常温下单质为固体 |
E | 在短周期元素中,原子半径最大 |
F | M 层比L 层少 1 个电子 |
请根据上述信息,完成下列问题:
(1)请给出元素 D 在元素周期表中的位置:________。
(2)请将 A、D、E、F 四种元素的简单离子按照离子半径由大到小排序(用离子符号表示):__________。
(3)请给出化合物 BFC 的电子式:______。
(4)用电子式表示 E 与 F 形成化合物 EF 的过程:______。
(5)请将 A、D、F 三种元素的最高价氧化物对应的水化物按照酸性由强到弱排序(用化学式表示):__________。
(6)元素 A 的单质常用于野外焊接钢轨,请写出该反应的化学方程式:________。
(7)单质 A 能溶于 E 的最高价氧化物对应水化物的水溶液,请给出该反应的离子方程式:_____________。
【答案】第三周期 VIA 族 S2- > Cl- > Na+ > Al3+ ![]()
 HClO4 > H2SO4> Al(OH)3 2Al + Fe2O3
HClO4 > H2SO4> Al(OH)3 2Al + Fe2O3![]() Al2O3 + 2Fe 2Al + 2OH- + 2H2O=2
Al2O3 + 2Fe 2Al + 2OH- + 2H2O=2![]() + 3H2↑
+ 3H2↑
【解析】
A为地壳中含量最多的金属元素,则A为Al;B的原子核外电子数和周期序数相等,则B为H;C原子的最外层电子数是次外层电子数的 3 倍,则C为O;D的最高正价与最低负价代数和为 4,常温下单质为固体,则D为S;E在短周期元素中,原子半径最大,则E为Na;F原子的M 层比L 层少 1 个电子,则F为Cl。
(1)元素 D 为S,电子排布为2、8、6,在元素周期表中的位置:第三周期 VIA 族。答案为:第三周期 VIA 族;
(2)A、D、E、F 分别为Al、S、Na、Cl,四种元素的简单离子中,S2-、Cl-比Na+、Al3+多一个电子层,按照离子半径由大到小排序为:S2- > Cl- > Na+ > Al3+。答案为:S2- > Cl- > Na+ > Al3+;
(3)化合物 BFC 的化学式为HClO,电子式为![]() 。答案为:
。答案为:![]() ;
;
(4) E 与 F 分别为Na、Cl,形成化合物 NaCl的过程为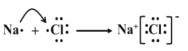 。答案为:
。答案为: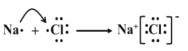 ;
;
(5)A、D、F 三种元素分别为Al、S、Cl,非金属性越强,最高价氧化物对应的水化物的酸性越强,所以按照酸性由强到弱排序(用化学式表示)为:HClO4 > H2SO4> Al(OH)3。答案为:HClO4 > H2SO4> Al(OH)3;
(6)元素 A 为Al,它的单质与氧化铁反应常用于野外焊接钢轨,该反应的化学方程式:2Al + Fe2O3![]() Al2O3 + 2Fe。答案为:2Al + Fe2O3
Al2O3 + 2Fe。答案为:2Al + Fe2O3![]() Al2O3 + 2Fe;
Al2O3 + 2Fe;
(7)单质 Al 能溶于 NaOH的水溶液,生成NaAlO2和H2,该反应的离子方程式为:2Al + 2OH- + 2H2O=2![]() + 3H2↑。答案为:2Al + 2OH- + 2H2O=2
+ 3H2↑。答案为:2Al + 2OH- + 2H2O=2![]() + 3H2↑。
+ 3H2↑。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)![]() 0.1 mol/L
0.1 mol/L