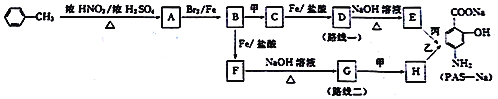
题目内容
【题目】Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为________。
(2)配合物K4Fe(CN)6的中心离子的价电子排布图为______,该中心离子的配位数是_______。
(3)1mol HCN分子中含有σ键的数目为_______,HCN分子中碳原子轨道杂化类型是_______,与CN-互为等电子体的阴离子是_______。
(4)K2CO3中阴离子的空间构型为_________,其中碳原子的价层电子对数为____________。
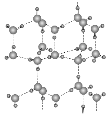
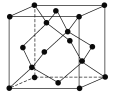
(5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞中有________个氢键,若氢键键长为d nm,则晶体密度(g·cm-3)计算式为_______ (用NA表示阿伏加德罗常数的值)。
【答案】C<N<O ![]() 6 1.204×1024 sp杂化 C22- 平面三角形 3 16 ρ=
6 1.204×1024 sp杂化 C22- 平面三角形 3 16 ρ=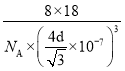
【解析】
(1)C、N、O三者为同周期元素,从左到右的顺序为C、N、O,非金属性C<N<O,则电负性的大小关系为C<N<O。答案为:C<N<O;
(2)配合物K4Fe(CN)6的中心离子为Fe2+,价电子排布式为3d6,则价电子排布图为![]() ,该中心离子的配体为CN-,配位数为6。答案为:
,该中心离子的配体为CN-,配位数为6。答案为:![]() ;6;
;6;
(3)2个原子间只能形成1个σ键,由此可确定1mol H-C≡N分子中含有σ键的数目为2×6.02×1023=1.204×1024,HCN分子中碳原子的价电子对数为2,则轨道杂化类型为sp杂化,与CN-互为等电子体的阴离子为C22-等。答案为:1.204×1024;sp杂化;C22-;
(4)K2CO3中阴离子为CO32-,中心碳原子形成1个碳氧双键和2个碳氧单键,阴离子的空间构型为平面三角形,其中碳原子的价层电子对数为3。答案为:平面三角形;3;
(5)冰的晶胞内部,共有4个水分子,每个水分子与周围水分子形成4个氢键,由此可确定在一个晶胞中氢键的数目为4×4=16;我们划定一个三角形如图![]() 中的二分之一,三个水分子分别位于顶点、面心和体内,则斜边为d nm,设晶胞的边长是anm,则两直角边分别为
中的二分之一,三个水分子分别位于顶点、面心和体内,则斜边为d nm,设晶胞的边长是anm,则两直角边分别为![]() a nm和
a nm和![]() a nm,则(
a nm,则(![]() a)2+(
a)2+(![]() a)2=d2,a=
a)2=d2,a=![]() nm,在1个晶胞中,共含有8个水分子,则ρ=
nm,在1个晶胞中,共含有8个水分子,则ρ=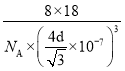 g·cm-3。答案为:16;ρ=
g·cm-3。答案为:16;ρ=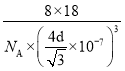 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】化工发展是我国能源安全的重要保证。近年来,我国煤化工技术获得重大突破,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇(CH3OH)是其中的一个研究项目。该研究发生的主要反应如下:
Ⅰ.CO与H2反应合成甲醇
Ⅱ.CO2与H2反应合成甲醇 CO2(g)+3H2(g)CH3OH(g)+H2O(g)
(1)上述反应Ⅰ是原子经济性反应,写出化学反应方程式___________。
(2)在工业上,为了提高上述反应Ⅱ的反应速率,除了采用合适的催化剂之外,还可以采取的措施是_______(填一项即可)。
(3)一定温度下,在容积固定的密闭容器中发生反应Ⅱ,下列可以表明反应达到化学平衡状态的是_____。
a.单位时间消耗nmolCO2的同时,消耗3n mol的H2
b.容器内CH3OH的浓度不再改变
c.容器内气体压强不再改变
d.容器内气体密度不再改变
(4)生成1mol CH3OH放出 a kJ的能量,反应Ⅰ中拆开1mol化学键所需的能量(E)的相关数据如下:
化学键 | H—H | C—O | CO中的 C | H—O | C—H |
E(kJ) | m | n | E1 | x | y |
根据相关数据计算拆开1molC![]() O所需的能量E1=______________kJ。
O所需的能量E1=______________kJ。
(5) H2还原CO2电化学法制备甲醇的工作原理如下图所示: ![]()
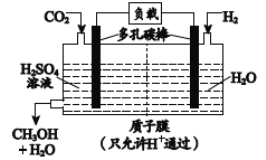
通入H2 的一端是电池的________极(填“正”或“负”),通入CO2的一端发生的电极反应式为_______。
【题目】现有 A、B、C、D、E、F 六种短周期主族元素,其相关性质信息如下:
元素 | 相关信息 |
A | 地壳中含量最多的金属元素 |
B | 原子核外电子数和周期序数相等 |
C | 最外层电子数是次外层电子数的 3 倍 |
D | 最高正价与最低负价代数和为 4,常温下单质为固体 |
E | 在短周期元素中,原子半径最大 |
F | M 层比L 层少 1 个电子 |
请根据上述信息,完成下列问题:
(1)请给出元素 D 在元素周期表中的位置:________。
(2)请将 A、D、E、F 四种元素的简单离子按照离子半径由大到小排序(用离子符号表示):__________。
(3)请给出化合物 BFC 的电子式:______。
(4)用电子式表示 E 与 F 形成化合物 EF 的过程:______。
(5)请将 A、D、F 三种元素的最高价氧化物对应的水化物按照酸性由强到弱排序(用化学式表示):__________。
(6)元素 A 的单质常用于野外焊接钢轨,请写出该反应的化学方程式:________。
(7)单质 A 能溶于 E 的最高价氧化物对应水化物的水溶液,请给出该反应的离子方程式:_____________。