题目内容
1.(1)将氧化铁还原为铁的技术在人类文明的进步中占有十分重要的地位.炼铁高炉中发生的关键反应如下:C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
CO2(g)+C(s)═2CO(g)△H=172.46kJ•mol-1
Fe2O3+CO→Fe+CO2
已知:2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s)△H=-824.21kJ•mol-1
写出高炉内Fe2O3被CO还原为Fe的热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.74kJ•mol-1.
(2)炼制1t(吨)含铁96%的生铁需焦炭的理论用量是0.3086t,实际生产中所需焦炭远高于理论用量,其原因是焦炭没有被充分利用.
分析 (1)①C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②CO2(g)+C(s)═2CO(g)△H=172.46kJ•mol-1
③2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s)△H=-824.21kJ•mol-1
则根据盖斯定律①×$\frac{3}{2}$-②×$\frac{3}{2}$+③进行分析计算;
(2)根据炼铁的方程式2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO,Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2进行计算.
解答 解:(1)①C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②CO2(g)+C(s)═2CO(g)△H=172.46kJ•mol-1
③2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s)△H=-824.21kJ•mol-1
则根据盖斯定律①×$\frac{3}{2}$-②×$\frac{3}{2}$-③,得Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-393.5×$\frac{3}{2}$-172.46×$\frac{3}{2}$+824.2=-24.74kJ•mol-1,故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.74kJ•mol-1;
(2)设CO质量为x
Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
84 112
x 0.96t
x=0.72t
设C的质量为y
2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO
24 56
y 0.72t
y=0.3086t
又焦炭没有被充分利用,所以实际生产中所需焦炭远高于理论用量,
故答案为:0.3086;焦炭没有被充分利用.
点评 本题考查盖斯定律的应用以及化学方程式的有关计算,正确应用盖斯定律是解本题关键,题目难度不大.

| A. | Na+、Al3+、Cl-、AlO2- | B. | Ba2+、NH4+、Cl-、OH-、 | ||
| C. | H3O+、Cu2+、SO42-、Cl- | D. | Na+、Al3+、Cl-、H+ |
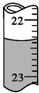 用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )
用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )| A. | 22.30 mL | B. | 22.35 mL | C. | 23.65 mL | D. | 23.70 mL |

| A. | 图1表示相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 | |
| B. | 图2中纯水仅升高温度,就可以从a点变到c点 | |
| C. | 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性 | |
| D. | 用0.0100mol/L硝酸银标准溶液,滴定Cl-、Br-及I-且浓度均为0.1000mol/L的混合溶液,由图3曲线,可确定首先沉淀的是Cl- |
| A. | 3.01×1023 | B. | 6.02×1023 | C. | 0.5 | D. | 1 |
| A. | 向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减少 | |
| B. | 一定温度下,向一定量纯水中通入少量HCl气体后,水的电离平衡正向移动 | |
| C. | 中和等体积等物质的量浓度的氨水和NaOH溶液时,消耗等浓度的稀硫酸的体积氨水比NaOH溶液多 | |
| D. | 室温下,pH=5的硫酸铵和pH=9醋酸钠两溶液中,由水电离出的氢离子浓度相等 |
| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$不变 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 再加入10mL pH=11的NaOH溶液,混合液pH=7 |
| A. | 两个键的之间夹角为120° | B. | B-F键的键能相同 | ||
| C. | 3个B-F键的键能相同 | D. | 3个B-F键的键长相等 |
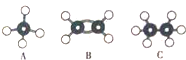 现有A、B、C三种烃,其球棍模型如图:
现有A、B、C三种烃,其球棍模型如图: .
.