题目内容
20.将100mL 2mol/L的硫酸与50mL 1mol/L的硫酸铜混合,并加水稀释至500mL.(1)稀释后溶液中c(SO42-)=0.5mol/L;
(2)至少需要加入100mL 5mol/L的NaOH才能将稀释后溶液中的Cu2+完全沉淀.
分析 (1)根据n=cV计算出两溶液中溶质的物质的量,再计算出硫酸根离子的物质的量,最后根据c=$\frac{n}{V}$计算出混合液中硫酸根离子的物质的量浓度;
(2)铜离子转化成沉淀时,氢离子必须完全被中和,反应后溶质为硫酸钠,根据质量守恒计算出需要氢氧化钠的物质的量,再根据V=$\frac{n}{c}$计算出需要该氢氧化钠溶液的体积.
解答 解:(1)100mL 2mol/L的硫酸溶液中含有硫酸的物质的量为:2mol/L×0.1L=0.2mol,
50mL 1mol/L的硫酸铜溶液中含有溶质硫酸铜的物质的量为:1mol/L×0.05L=0.05mol,
混合液中含有硫酸根离子的物质的量为:0.5mol+0.05mol=0.25mol,
则混合液中硫酸根离子的物质的量浓度为:c(SO42-)=$\frac{0.25mol}{0.5L}$=0.5mol/L,
故答案为:0.5mol/L;
(2)将稀释后溶液中的Cu2+完全沉淀,此时溶质为硫酸钠,根据质量守恒可知,消耗氢氧化钠的物质的量为:n(NaOH)=2n(SO42-)=0.5mol/L×0.5L×2=0.5mol,需要5mol/L的氢氧化钠溶液的体积为:$\frac{0.5mol}{5mol/L}$=0.1L=100mL,
故答案为:100.
点评 本题考查了物质的量的计算,题目难度中等,明确物质的量浓度的概念为解答关键,(2)为易错点,需要掌握质量守恒定律在化学计算中的应用方法.

练习册系列答案
相关题目
10.关于物质的量的叙述正确的是( )
| A. | 常温常压下,4.4gCO2物质的量为0.1 mol | |
| B. | 常温常压下,6.2g Na2O含有的Na+离子数为0.1mol | |
| C. | 标准状况下,1 NA个H2O分子含有氢分子数为1 mol | |
| D. | 标准状况下,22.4L酒精的物质的量为1mol |
11.将下列离子混合在同一溶液中,必然会产生沉淀的一组是( )
| A. | Na+、Al3+、Cl-、AlO2- | B. | Ba2+、NH4+、Cl-、OH-、 | ||
| C. | H3O+、Cu2+、SO42-、Cl- | D. | Na+、Al3+、Cl-、H+ |
8.下列说法中正确的是( )
| A. | 硫酸的摩尔质量是98 g | |
| B. | 摩尔是物质质量的单位 | |
| C. | 氮原子的质量就是氮的相对原子质量 | |
| D. | 氧气的摩尔质量(单位:g•mol-1)在数值上等于它的相对分子质量 |
15.下列叙述正确的是( )
| A. | 含有金属元素的离子一定是阳离子 | |
| B. | 金属阳离子被还原,一定得到金属单质 | |
| C. | 有单质参与的化合反应一定是氧化还原反应 | |
| D. | 在氧化还原反应中,非金属单质一定是氧化剂 |
5.下列化学反应中,硝酸既表现了氧化性又表现了酸性的是( )
| A. | 氧化铁与硝酸反应 | B. | 木炭与浓硝酸反应 | ||
| C. | 铜与硝酸反应 | D. | 氢氧化铝与硝酸反应 |
12.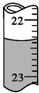 用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )
用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )
 用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )
用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )| A. | 22.30 mL | B. | 22.35 mL | C. | 23.65 mL | D. | 23.70 mL |
9.下列图示与对应的叙述相符的是( )


| A. | 图1表示相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 | |
| B. | 图2中纯水仅升高温度,就可以从a点变到c点 | |
| C. | 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性 | |
| D. | 用0.0100mol/L硝酸银标准溶液,滴定Cl-、Br-及I-且浓度均为0.1000mol/L的混合溶液,由图3曲线,可确定首先沉淀的是Cl- |
19.室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$不变 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 再加入10mL pH=11的NaOH溶液,混合液pH=7 |