题目内容
10.CO2的资源化利用是解决温室效应的重要途径.以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应: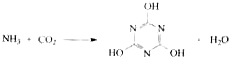 下列有关三聚氰胺的说法正确的是( )
下列有关三聚氰胺的说法正确的是( )| A. | 分子式为C3H6N3O3 | B. | 分子中既含极性键,又含非极性键 | ||
| C. | 属于共价化合物 | D. | 生成该物质的上述反应为中和反应 |
分析 A.根据三聚氰酸的结构简式书写分子式;
B.分子中化学键都是不同原子之间形成的共价键,都是极性键;
C.三聚氰酸分子是原子之间通过共价键形成的分子,属于共价化合物;
D.酸与碱反应生成盐与水的反应为中和反应.
解答 解:A.由三聚氰酸的结构简式可知,其分子式为C3H3N3O3,故A错误;
B.分子中化学键都是不同原子之间形成的共价键,都是极性键,不存在非极性键,故B错误;
C.三聚氰酸分子是原子之间通过共价键形成的分子,属于共价化合物,故C正确;
D.该反应不符合酸与碱反应生成盐与水,不是中和反应,故D错误,
故选C.
点评 本题考查有机物结构与性质,侧重对基础知识的巩固,涉及化学键、共价化合物、化学反应类型等,难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
20.常温下,下列是人体中几种体液的正常pH,碱性最强的是( )
| A. | 血浆(7.35~7.45) | B. | 胰液(7.5~8.0) | C. | 胃液(0.9~1.5) | D. | 唾液(6.6~7.1) |
1.在恒温恒容条件下,能使A(g)+B(g)?C(g)+D(g)正反应速率增大的措施是( )
| A. | 增大C或D的浓度 | B. | 减小B或A的浓度 | C. | 减小C或D的浓度 | D. | 充入稀有气体 |
18.(CN)2、(SCN)2等的性质与卤素单质相似,在化学上称为“类卤素”;CN-、SCN-等的性质也与卤离子相似,称为“类卤离子”;不同卤原子能组成卤素互化物,如溴化碘IBr,下面叙述正确的是( )
| A. | (CN)2在碱溶液中生成CN-和OCN- | |
| B. | IBr+2NaOH═NaBr+NaIO+H2O | |
| C. | 均能在空气中燃烧 | |
| D. | IBr与苯发生取代反应生成溴苯和碘化氢 |
5.设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A. | 1 mol S与足量Fe反应,转移的电子数为3NA个 | |
| B. | 1.5 mol NO2与足量H2O反应,转移的电子数为2NA个 | |
| C. | 常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA个 | |
| D. | 100 ml 0.10mol/L的氨水中,含NH3•H2O 分子0.01NA个 |
15.甲醇和氧气以及强碱作电解质溶液新型手机电池,电量可达到现在用镍氢或锂电池的十倍,可连续使用一个月才充一次电.该电池反应的离子方程式是:2CH3OH+3O2+4OH-═2CO32-+6H2O.据此判断下列说法正确( )
| A. | CH3OH在负极上失去电子,O2在正极上得到电子 | |
| B. | 溶液中OH-向正极移动,H+向负极移动 | |
| C. | CH3OH发生还原反应,O2发生氧化反应 | |
| D. | 随着电极反应的不断进行,电解质溶液的pH值基本保持不变 |
2.ag铜、铁与一定量浓硝酸完全反应后,向所得到溶液中加入KSCN溶液无明显变化(即溶液中无Fe3+存在),将所得气体与1.68L O2(标准状况)混合后通入水中,所有气体能完全被水吸收生成硝酸.若向所得溶液中加入足量NaOH溶液至恰好完全沉淀,则最后生成沉淀的质量为( )
| A. | (a+1.25) | B. | (a+9.6 )g | C. | (a+5.1)g | D. | 无法确定 |
20.下列关于有机化合物的认识不正确的是( )
| A. | 油脂在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 | |
| C. | 在水溶液里,乙酸分子中的-CH3可以电离出H+ | |
| D. | 医学上了利用银镜反应来检验患者尿液中葡萄糖含量是否偏高 |
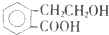 ,它可通过不同化学反应分别制得B、C、D、E四种物质.
,它可通过不同化学反应分别制得B、C、D、E四种物质.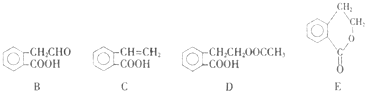
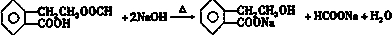 .
.