题目内容
18.(CN)2、(SCN)2等的性质与卤素单质相似,在化学上称为“类卤素”;CN-、SCN-等的性质也与卤离子相似,称为“类卤离子”;不同卤原子能组成卤素互化物,如溴化碘IBr,下面叙述正确的是( )| A. | (CN)2在碱溶液中生成CN-和OCN- | |
| B. | IBr+2NaOH═NaBr+NaIO+H2O | |
| C. | 均能在空气中燃烧 | |
| D. | IBr与苯发生取代反应生成溴苯和碘化氢 |
分析 A.(CN)2与卤素单质的性质相似,可以发生类似氯气与碱的反应,与碱发生反应(CN)2+2OH-=CN-+CNO-+H2O;
B、溴化碘IBr与碱反应生成NaBr和NaIO,也可以认为溴化碘IBr首先与水反应生成氢溴酸和次碘酸,然后氢溴酸和次碘酸与氢氧化钠反应;
C、溴化碘IBr不能在空气中燃烧;
D、C6H6和IBr反应生成C6H5I和HBr.
解答 解:A.(CN)2与卤素单质的性质相似,可以发生类似氯气与碱的反应,与碱发生反应(CN)2+2OH-=CN-+CNO-+H2O,故A错误;
B、溴化碘IBr与碱反应生成NaBr和NaIO,也可以认为溴化碘IBr首先与水反应生成氢溴酸和次碘酸,然后氢溴酸和次碘酸与氢氧化钠反应,生成NaBr和NaIO,故B正确;
C、溴化碘IBr不能在空气中燃烧,故C错误;
D、C6H6和IBr反应生成C6H5I和HBr,而不是溴苯和碘化氢,故D错误;
故选B.
点评 本题考查拟卤素知识、氧化还原反应、离子方程式的书写等,需要学生对信息应用进行利用,注意把握题中信息,“拟卤素”与卤素单质的性质相似.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
9.短周期主族元素A、B、C、D,原子序数依次增大.A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )
| A. | 原子半径:A<B<C<D | |
| B. | 非金属性:C>A | |
| C. | 最高价氧化物对应水化物的酸性:D>C | |
| D. | 单质B常温下能溶于浓硝酸 |
6.赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿按一定比例混合加热可制得铜:2Cu2O+Cu2S $\frac{\underline{\;\;△\;\;}}{\;}$6Cu+SO2↑.对于该反应,下列说法中正确的是( )
| A. | 该反应中的氧化剂只有Cu2O | |
| B. | 氧化产物和还原产物的物质的量之比为6:1 | |
| C. | Cu既是氧化产物又是还原产物 | |
| D. | Cu2S在反应中既是氧化剂又是还原剂 |
3.电解稀H2SO4、CuCl2的混合液,最初一段时间阴极和阳极上分别析出的物质分别是( )
| A. | H2和Cl2 | B. | Cu和 Cl2 | C. | H2和O2 | D. | Cu和O2 |
10.CO2的资源化利用是解决温室效应的重要途径.以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应: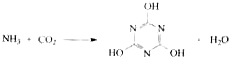 下列有关三聚氰胺的说法正确的是( )
下列有关三聚氰胺的说法正确的是( )
 下列有关三聚氰胺的说法正确的是( )
下列有关三聚氰胺的说法正确的是( )| A. | 分子式为C3H6N3O3 | B. | 分子中既含极性键,又含非极性键 | ||
| C. | 属于共价化合物 | D. | 生成该物质的上述反应为中和反应 |
7.下列各有机物的系统命名正确的是( )
| A. | 2,3,3-三甲基丁烷 | B. | 2-乙基丙烷 | ||
| C. | 2-甲基-2-丁烯 | D. | 2,2-二甲基-1,3-丁二烯 |
8.下列物质之间的相互关系不正确的是( )
| A. | ${\;}_{6}^{12}$C和${\;}_{6}^{14}$C互为同位素 | B. | 02和03互为同素异形体 | ||
| C. | 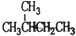 和 和 互为同分异构体 互为同分异构体 | D. | 干冰和冰为不同种物质 |
 H、C、O、N、S、Cl是常见的几种非金属元素.
H、C、O、N、S、Cl是常见的几种非金属元素. .
. CH3COOCH2CH=CH2+H218O,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式
CH3COOCH2CH=CH2+H218O,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式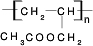 .
.