题目内容
2.ag铜、铁与一定量浓硝酸完全反应后,向所得到溶液中加入KSCN溶液无明显变化(即溶液中无Fe3+存在),将所得气体与1.68L O2(标准状况)混合后通入水中,所有气体能完全被水吸收生成硝酸.若向所得溶液中加入足量NaOH溶液至恰好完全沉淀,则最后生成沉淀的质量为( )| A. | (a+1.25) | B. | (a+9.6 )g | C. | (a+5.1)g | D. | 无法确定 |
分析 铜、铁先被硝酸氧化,向所得到溶液中加入KSCN溶液无明显变化,说明铁反应生成硝酸亚铁,然后生成气体又被O2氧化成硝酸,所以可以直接认为ag铜、铁失的电子被1.68LO2获得,由于没有生成三价铁,所以铜和铁都是失2个电子,根据电荷守恒可得金属失去电子物质的量等于氢氧根离子的物质的量,沉淀质量为金属质量以氢氧根离子质量之和.
解答 解:铜、铁先被硝酸氧化,向所得到溶液中加入KSCN溶液无明显变化,说明铁反应生成硝酸亚铁,然后生成气体又被O2氧化成硝酸,所以可以直接认为ag铜、铁失的电子被1.68LO2获得,根据电子转移守恒,故金属失去的电子为:$\frac{1.68L}{22.4L/mol}$×4=0.3mol,
根据电荷守恒可得金属失去电子物质的量等于氢氧根离子的物质的量=0.3mol,
则生成沉淀质量为:ag+0.3mol×17g/mol=(a+5.1)g,
故选C.
点评 本题考查混合物反应计算、氧化还原反应计算,题目难度中等,利用常规方无法解答,是守恒思想在混合计算典型利用,判断金属失去的电子等于氧气获得的电子是关键.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
12.把纯碘化氢气体装入密闭容器中,它将按2HI?H2+I2反应进行分解(正反应吸热),当系统在趋向平衡状态的过程中,以下描述正确的是( )
| A. | 碘化氢的生成速率大于其分解速率 | |
| B. | 碘化氢的生成速率等于其分解速率 | |
| C. | 加催化剂不会影响达到平衡的时间 | |
| D. | 升高温度可以缩短到达平衡状态的时间 |
10.CO2的资源化利用是解决温室效应的重要途径.以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应: 下列有关三聚氰胺的说法正确的是( )
下列有关三聚氰胺的说法正确的是( )
 下列有关三聚氰胺的说法正确的是( )
下列有关三聚氰胺的说法正确的是( )| A. | 分子式为C3H6N3O3 | B. | 分子中既含极性键,又含非极性键 | ||
| C. | 属于共价化合物 | D. | 生成该物质的上述反应为中和反应 |
17.相同温度,相同物质的量浓度的四种溶液:①CH3COONa ②NaHSO4 ③NaCl ④C6H5-ONa ⑤NaHCO3 ⑥Na2CO3,按pH由大到小的顺序排列,正确的是( )
| A. | ⑥>⑤>④>①>③>② | B. | ⑥>④>⑤>①>③>② | C. | ⑥>④>⑤>①>②>③ | D. | ⑥>⑤>④>①>③>② |
7.下列各有机物的系统命名正确的是( )
| A. | 2,3,3-三甲基丁烷 | B. | 2-乙基丙烷 | ||
| C. | 2-甲基-2-丁烯 | D. | 2,2-二甲基-1,3-丁二烯 |
14.与NH4+互为等电子体的微粒是( )
| A. | H3O+ | B. | OH- | C. | NH3 | D. | CH4 |
 CH3COOCH2CH=CH2+H218O,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式
CH3COOCH2CH=CH2+H218O,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式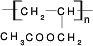 .
. C2H4(g)①
C2H4(g)①