题目内容
16.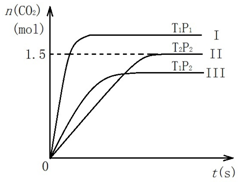 在密闭容器中通入NO和CO各2mol发生反应:2NO(g)+2CO(g)?2CO2(g)+N2(g).容器内CO2随温度(T)、压强(P)和时间(t)的变化曲线如图所示.以下说法合理的是( )
在密闭容器中通入NO和CO各2mol发生反应:2NO(g)+2CO(g)?2CO2(g)+N2(g).容器内CO2随温度(T)、压强(P)和时间(t)的变化曲线如图所示.以下说法合理的是( )| A. | 温度T2>T1 | B. | 压强P2>P1 | ||
| C. | II曲线表示NO平衡转化率为25% | D. | 该反应的焓变△H<0 |
分析 根据图示的曲线Ⅰ、Ⅲ,可知压强关系式P1>P2,图示的曲线Ⅱ、Ⅲ,温度关系是:T1>T2,温度升高,二氧化碳的物质的量减小,所以平衡向着逆方向进行,所以正像是放热反应,即△H<0,根据三段式来进行计算NO平衡转化率,由此分析解答.
解答 解:A、在两条等压线中,结合图示的曲线Ⅱ、Ⅲ,根据先拐反应速率快,对应的温度高,所以温度关系是:T1>T2,故A错误;
B、在两条等温线中,结合图示的曲线Ⅰ、Ⅲ,根据先拐反应速率快,对应压强高,所以压强关系式P1>P2,故B错误;
C、根据曲线II,
2NO(g)+2CO(g)?2CO2(g)+N2(g)
初始:2 2 0 0
变化:1.5 1.5 1.5 0.75
平衡:0.5 0.5 1.5 0.75
所以NO平衡转化率为$\frac{1.5}{2}$×100%=75%,故C错误;
D、温度升高,二氧化碳的物质的量减小,所以平衡向着逆方向进行,所以正像是放热反应,即△H<0,故D正确;
故选D.
点评 本题涉及化学反应速率的影响因素、化学平衡的有关计算的知识,属于综合知识的考查,难度大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
6.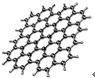 从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质,可制成电阻率最小的纳米材料,其结构如图所示.下列关于石墨烯的说法正确的是( )
从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质,可制成电阻率最小的纳米材料,其结构如图所示.下列关于石墨烯的说法正确的是( )
 从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质,可制成电阻率最小的纳米材料,其结构如图所示.下列关于石墨烯的说法正确的是( )
从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质,可制成电阻率最小的纳米材料,其结构如图所示.下列关于石墨烯的说法正确的是( )| A. | 具有良好的导电性 | B. | 属于高分子化合物 | ||
| C. | 与金刚石互为同位素 | D. | 不能与氧气发生反应 |
4.76.8mgCu与足量浓硝酸反应,铜作用完全后,如果NO3-减少2×10-3mol,则溶液中H+同时下降( )
| A. | 2.2×10-3mol | B. | 3.2×10-3mol | C. | 4.4×10-3mol | D. | 4.8×10-3mol |
11.汽车排气管加装催化装置,可有效减少CO和NOx的排放.催化装置内发生的反应为:NOx+CO→N2+CO2,下列说法一定正确的是( )
| A. | 上述氧化物均为酸性氧化物 | |
| B. | 反应中既有极性键也有非极性键形成 | |
| C. | 当x=2时,转移的电子数为4×6.02×1023 | |
| D. | 该反应为置换反应 |
8.(多项选择题)下列有机物分子中的所有碳原子一定在同一平面上的是( )
| A. | 乙苯 | B. | 反-2-丁烯 | C. | 环己烷 | D. | 对二甲苯 |
5.常温下,在下列指定条件的各溶液中,一定能大量共存的离子组是( )
| A. | 含0.1 mol/L-1SO2的溶液中:Na+、Ba2+、Br-、Cl- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、Mg2+、NO3-、SO42- | |
| C. | 碱性溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 不能使酚酞变红的无色溶液中:Na+、K+、MnO4-、I- |
6.短周期主族元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.Z原子的最外层电子数是X原子内层电子数的3倍,也是Y原子最外层电子数的3倍.X与Y、Z位于相邻的周期.下列说法正确的是( )
| A. | X的最高价氧化物对应的水化物是弱酸 | |
| B. | 元素Z位于元素周期表的第3周期Ⅵ族 | |
| C. | Y形成的单质能在二氧化碳中燃烧 | |
| D. | 原子半径的大小顺序:r(Z)>r(Y)>r(X) |
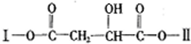 (其中I、II为未知部分的结构)为推测X的分子结构,进行如图的转化:
(其中I、II为未知部分的结构)为推测X的分子结构,进行如图的转化: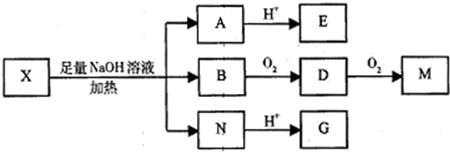
 ;
;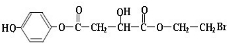 ;
;