题目内容
5.常温下,在下列指定条件的各溶液中,一定能大量共存的离子组是( )| A. | 含0.1 mol/L-1SO2的溶液中:Na+、Ba2+、Br-、Cl- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、Mg2+、NO3-、SO42- | |
| C. | 碱性溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 不能使酚酞变红的无色溶液中:Na+、K+、MnO4-、I- |
分析 A.四种离子之间不发生反应,都不与二氧化硫反应;
B.该溶液为酸性或强碱性溶液,镁离子与碱性溶液中的氢氧根离子反应,硝酸根离子在酸性溶液中具有强氧化性,与铝反应不会生成氢气;
C.铵根离子与碱性溶液中的氢氧根离子反应;
D.不能使酚酞变红的无色溶液中可能为酸性溶液,酸性溶液中高锰酸根离子能够氧化碘离子.
解答 解:A.Na+、Ba2+、Br-、Cl-之间不反应,都不与SO2反应,在溶液中能够大量共存,故A正确;
B.能与金属铝反应放出氢气的溶液可能为酸性或强碱性溶液,Mg2+与强碱性溶液中的氢氧根离子反应生成氢氧化镁沉淀,NO3-在酸性溶液中具有强氧化性,加入铝粉后不会生成氢气,故B错误;
C.碱性溶液中存在大量氢氧根离子,NH4+与氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.MnO4-、I-之间发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的正误判断,为中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存等.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
15.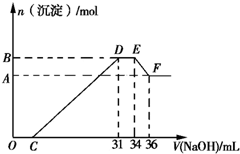 硝酸的还原产物比较复杂,硝酸越稀,还原产物中氮元素的化合价越低.某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出.在反应结束后的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列说法不正确的是( )
硝酸的还原产物比较复杂,硝酸越稀,还原产物中氮元素的化合价越低.某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出.在反应结束后的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列说法不正确的是( )
 硝酸的还原产物比较复杂,硝酸越稀,还原产物中氮元素的化合价越低.某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出.在反应结束后的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列说法不正确的是( )
硝酸的还原产物比较复杂,硝酸越稀,还原产物中氮元素的化合价越低.某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出.在反应结束后的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列说法不正确的是( )| A. | 反应中硝酸的还原产物为NH4+ | |
| B. | DE段反应的离子方程式为:NH4++OH-═NH3•H2O | |
| C. | 合金中铁和铝的物质的量之比为1:3 | |
| D. | 图象中C点所加NaOH溶液的体积为7mL |
16.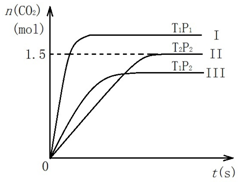 在密闭容器中通入NO和CO各2mol发生反应:2NO(g)+2CO(g)?2CO2(g)+N2(g).容器内CO2随温度(T)、压强(P)和时间(t)的变化曲线如图所示.以下说法合理的是( )
在密闭容器中通入NO和CO各2mol发生反应:2NO(g)+2CO(g)?2CO2(g)+N2(g).容器内CO2随温度(T)、压强(P)和时间(t)的变化曲线如图所示.以下说法合理的是( )
 在密闭容器中通入NO和CO各2mol发生反应:2NO(g)+2CO(g)?2CO2(g)+N2(g).容器内CO2随温度(T)、压强(P)和时间(t)的变化曲线如图所示.以下说法合理的是( )
在密闭容器中通入NO和CO各2mol发生反应:2NO(g)+2CO(g)?2CO2(g)+N2(g).容器内CO2随温度(T)、压强(P)和时间(t)的变化曲线如图所示.以下说法合理的是( )| A. | 温度T2>T1 | B. | 压强P2>P1 | ||
| C. | II曲线表示NO平衡转化率为25% | D. | 该反应的焓变△H<0 |
13.下列指定反应的离子方程式正确的是( )
| A. | 用足量的氢氧化钠溶液吸收二氧化氮:3NO2+2OH-═2NO3-+NO+H2O | |
| B. | 用过量的氨水吸收烟道气中的SO2:SO2+2NH3•H2O=2NH4++SO32-+H2O | |
| C. | NH4Al(SO4)2溶液与过量NaOH溶液混合加热:NH4++Al3++4OH-═Al(OH)3↓+NH3↑+H2O | |
| D. | 向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-═2Mn2++5SO42-+2H2O |
20.已知碳碳单键可以绕键轴自由旋转,结构简式为如图所示的烃,下列说法中不正确的是( )
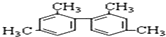

| A. | 等质量的该烃和甲烷均完全燃烧,耗氧量前者小于后者 | |
| B. | 该烃能使酸性高锰酸钾溶液褪色,属于苯的同系物 | |
| C. | 分子中一定有11个碳原子处于同一平面上 | |
| D. | 该烃的一氯取代产物为5种 |
17.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 14 g C2H4中含有2NA个C-H键 | |
| B. | 1 mol•L-1 NH3•H2O溶液中含有NA个NH4+ | |
| C. | 1 mol Na2O2和足量CO2反应产生NA个O2分子 | |
| D. | 常温常压下,22.4 L 的SO2中含有NA个SO2分子 |
14.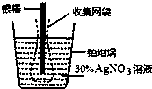 下图为根据电解原理制成“银电量计”.其原理是:通过测定电解过程中附着在惰性电极上金属质量,计算通过电解池的电量.下列说法正确的是( )
下图为根据电解原理制成“银电量计”.其原理是:通过测定电解过程中附着在惰性电极上金属质量,计算通过电解池的电量.下列说法正确的是( )
 下图为根据电解原理制成“银电量计”.其原理是:通过测定电解过程中附着在惰性电极上金属质量,计算通过电解池的电量.下列说法正确的是( )
下图为根据电解原理制成“银电量计”.其原理是:通过测定电解过程中附着在惰性电极上金属质量,计算通过电解池的电量.下列说法正确的是( )| A. | 电量计工作时溶液里的阴离子向正极移动 | |
| B. | 电量计工作时银棒应与电源的正极相连 | |
| C. | 网袋是收集银溶解过程中产生的金属颗粒,若没有该网袋,测量结果会偏低 | |
| D. | 若得金属银的沉积量为1.08g,则电解过程中转移的电子为0.01mol |
10.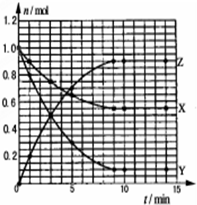 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如图所示,则下列说法错误的是( )
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如图所示,则下列说法错误的是( )
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如图所示,则下列说法错误的是( )
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如图所示,则下列说法错误的是( )| A. | 反应的化学方程式是X+2Y?2Z | |
| B. | 该反应在0-3min时间内产物Z的平均反应速率0.083mol•L-1•min-1 | |
| C. | 由图象知该反应吸收能量 | |
| D. | 其他条件不变,升高温度,若正反应速率增大,则逆反应速率将减小 |