题目内容
【题目】仔细分析下列实验:
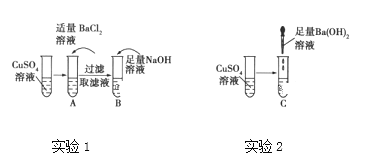
A、B、C试管中的现象如表所示:
试管 | A | B | C |
现象 | 产生白色沉淀, 溶液仍为蓝色 | 产生蓝色沉淀, 溶液变为无色 | 产生蓝色沉淀, 溶液变为无色 |
写出A、B、C试管中所发生反应的离子方程式。
(1)A:______________________________________________。
(2)B:______________________________________________。
(3)C:______________________________________________。
【答案】Ba2+ +SO42-=BaSO4↓Cu2++2OH-=Cu(OH)2↓Cu2++2OH-+Ba2+ +SO42-= BaSO4↓+ Cu(OH)2↓
【解析】
(1)BaCl2溶液和CuSO4溶液混合后,Ba2+和SO42-结合生成BaSO4白色沉淀,Cu2+和Cl-不反应,所以溶液仍然呈蓝色。反应的离子方程式为:Ba2+ +SO42-=BaSO4↓,
故答案为:Ba2+ +SO42-=BaSO4↓;
(2)向滤液中加入NaOH溶液,Cu2+和OH-反应生成Cu(OH)2蓝色沉淀。反应的离子方程式为:Cu2++2OH-=Cu(OH)2↓,
故答案为:Cu2++2OH-=Cu(OH)2↓;
(3)Ba(OH)2溶液和CuSO4溶液混合后,Cu2+和OH-反应生成Cu(OH)2蓝色沉淀,Ba2+和SO42-反应生成BaSO4白色沉淀。反应的离子方程式为:Cu2++2OH-+Ba2+ +SO42-= BaSO4↓+ Cu(OH)2↓。
故答案为:Cu2++2OH-+Ba2+ +SO42-= BaSO4↓+ Cu(OH)2↓。

练习册系列答案
相关题目