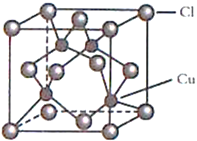
题目内容
【题目】以熔融Na2CO3为电解质,H2和CO混合气为燃料的电池,原理如下图所示。下列说法正确的是
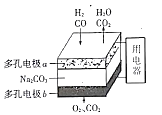
A. b是电池的负极
B. a电极的反应为:![]()
![]()
C. 电子由a电极经熔融Na2CO3向b电极移动
D. a、b两极消耗的气体的物质的量之比是1:1
【答案】B
【解析】A、b上为氧气得电子与二氧化碳反应生成碳酸根离子,则b是电池的正极,选项A错误;B、a为负极,负极上一氧化碳和氢气被氧化生成二氧化碳和水,电极a反应为:CO+CO32- -2e-=2CO2,H2+CO32- -2e-=H2O+CO2,选项B正确;C、根据选项A的分析,a为电池的负极,b为电池的负极,电子由经外电路由负极a流向正极b,选项C错误;D、电极a反应为:CO+CO32- -2e-=2CO2,H2+CO32- -2e-=H2O+CO2,b极反应为O2+CO2+4e-=2CO32-,则a、b两极消耗的气体的物质的量之比是2:1,选项D错误;答案选B。

练习册系列答案
相关题目
【题目】仔细分析下列实验:
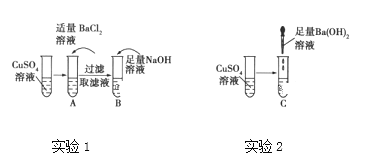
A、B、C试管中的现象如表所示:
试管 | A | B | C |
现象 | 产生白色沉淀, 溶液仍为蓝色 | 产生蓝色沉淀, 溶液变为无色 | 产生蓝色沉淀, 溶液变为无色 |
写出A、B、C试管中所发生反应的离子方程式。
(1)A:______________________________________________。
(2)B:______________________________________________。
(3)C:______________________________________________。