题目内容
【题目】钛被称为继铁、铝之后的第三金属,其单质及化合物在航天、军事、航海、医疗等领域都有着重要的应用。请回答下列问题:
(1)基态Ti 原子的价层电子排布图为________________________。
(2)在TiO、TiN、TiS2、TiCl4等化合物中,S、Cl的电负性大小:S________Cl (填“>”、“<”或“=”)。O、N 的第一电离能大小为O < N,原因是___________________________。
(3)TiCl4的熔点是-23℃,沸点是136℃,可溶于CCl4,该晶体是_______ 晶体。TiCl4中加入大量水,同时加热,可制得二氧化钛的水合物(TiO2·xH2O),再经焙烧可得TiO2,写出生
成二氧化钛水合物(TiO2·xH2O)的化学方程式_________________________________。
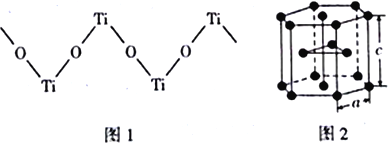
(4)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如下图1所示,其化学式为_____________。阴离子SO42-中硫原子的杂化方式为______________,写出一种与SO42-互为等电子体的分子_____________。
(5)下图2是钛晶体在空间的一种堆积方式,此堆积方式叫______________,钛原子的配位数为____________。已知:a=0.295 nm,c=0.469nm,则该钛晶体的密度为_________g·cm-3(NA表示阿伏加德罗常数的值,列出计算式即可)。
【答案】 ![]() < N原子的2P轨道为半充满状态,具有较高的稳定性,故不易失去一个电子 分子 TiCl4+ (x+2)H2O
< N原子的2P轨道为半充满状态,具有较高的稳定性,故不易失去一个电子 分子 TiCl4+ (x+2)H2O![]() TiO2·xH2O↓+4HCl (TiO)n2n+(或TiO2+) sp3 CCl4(SiCl4等) 六方最密堆积 12
TiO2·xH2O↓+4HCl (TiO)n2n+(或TiO2+) sp3 CCl4(SiCl4等) 六方最密堆积 12 ![]()
【解析】(1). Ti是22号元素,价层电子排布式为3d24s2,所以价层电子排布图为:![]() ,故答案为:
,故答案为:![]() ;
;
(2). Cl元素的非金属性比S强,所以Cl的电负性大于S,N元素的价层电子排布式为2s22p3,是一种半充满的稳定结构,具有较高的稳定性,不易失去一个电子,所以第一电离能O < N,故答案为:<;N原子的2P轨道为半充满状态,具有较高的稳定性,故不易失去一个电子;
(3). 由题中信息可知,TiCl4的熔点和沸点较低,可溶于有机溶剂,说明TiCl4是分子晶体,TiCl4中加入大量水的同时加热,发生水解反应生成TiO2·xH2O,反应的化学方程式为:TiCl4+ (x+2)H2O![]() TiO2·xH2O↓+4HCl,故答案为:分子;TiCl4+ (x+2)H2O
TiO2·xH2O↓+4HCl,故答案为:分子;TiCl4+ (x+2)H2O![]() TiO2·xH2O↓+4HCl;
TiO2·xH2O↓+4HCl;
(4). 由图1可知,每个Ti原子连接2个O原子,每个O原子连接2个Ti原子,说明Ti与O原子的个数比为1:1,则该阳离子的化学式为(TiO)n2n+(或TiO2+),SO42-中硫原子的价层电子对数为:4+![]() =4+0=4,所以硫原子的杂化方式为sp3,SO42-的原子数为5、价层电子数为32,根据等电子体原理,与SO42-互为等电子体的分子有:CCl4、SiCl4等,故答案为:(TiO)n2n+(或TiO2+);sp3;CCl4(SiCl4等);
=4+0=4,所以硫原子的杂化方式为sp3,SO42-的原子数为5、价层电子数为32,根据等电子体原理,与SO42-互为等电子体的分子有:CCl4、SiCl4等,故答案为:(TiO)n2n+(或TiO2+);sp3;CCl4(SiCl4等);
(5). 由图2可知,此堆积方式为六方最密堆积,与Ti原子最近且等距离的Ti原子有12个,所以钛原子的配位数为12,该六棱柱含有的钛原子数为6个,质量为![]() g,六棱柱的体积为
g,六棱柱的体积为![]() cm3,则该钛晶体的密度为
cm3,则该钛晶体的密度为![]() g·cm-3,故答案为:六方最密堆积;12;
g·cm-3,故答案为:六方最密堆积;12;![]() 。
。

【题目】仔细分析下列实验:
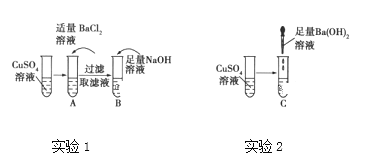
A、B、C试管中的现象如表所示:
试管 | A | B | C |
现象 | 产生白色沉淀, 溶液仍为蓝色 | 产生蓝色沉淀, 溶液变为无色 | 产生蓝色沉淀, 溶液变为无色 |
写出A、B、C试管中所发生反应的离子方程式。
(1)A:______________________________________________。
(2)B:______________________________________________。
(3)C:______________________________________________。