题目内容
1.工业上以铝土矿(主要成分是Al2O3,含杂质Fe2O3和SiO2)为原料生产铝,其生产流程如下: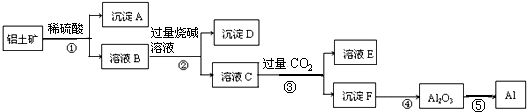
下列叙述错误的是( )
| A. | 沉淀A主要是SiO2 | B. | 步骤②的目的是分离Fe3+和Al3+ | ||
| C. | 溶液E溶质主要有碳酸钠和硫酸钠 | D. | ⑤主要是把电能转化为化学能 |
分析 铝土矿(主要成分是Al2O3,含杂质Fe2O3和SiO2)用稀硫酸溶解,发生的反应为Al2O3+3H2SO4=Al2(SO4)3+3H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,SiO2不溶于稀硫酸,然后过滤得到的沉淀A是SiO2,滤液B中含有硫酸铁、硫酸铝,向B中加入过量烧碱,发生反应Fe2(SO4)3+6NaOH=3Na2SO4+2 Fe(OH)3↓、Al2(SO4)3+8NaOH=3 Na2SO4+2NaAlO2+4H2O,所以沉淀C是 Fe(OH)3,滤液C中溶质是Na2SO4、NaAlO2、NaOH,向滤液C中通入过量二氧化碳,发生反应NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓、NaOH+CO2=NaHCO3,沉淀F是Al(OH)3,滤液E中成分是NaHCO3和Na2SO4,将沉淀氢氧化铝加热得到Al2O3,电解熔融Al2O3得到Al,据此分析解答.
解答 解:铝土矿(主要成分是Al2O3,含杂质Fe2O3和SiO2)用稀硫酸溶解,发生的反应为Al2O3+3H2SO4=Al2(SO4)3+3H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,SiO2不溶于稀硫酸,然后过滤得到的沉淀A是SiO2,滤液B中含有硫酸铁、硫酸铝,向B中加入过量烧碱,发生反应Fe2(SO4)3+6NaOH=3Na2SO4+2 Fe(OH)3↓、Al2(SO4)3+8NaOH=3 Na2SO4+2NaAlO2+4H2O,所以沉淀C是 Fe(OH)3,滤液C中溶质是Na2SO4、NaAlO2、NaOH,向滤液C中通入过量二氧化碳,发生反应NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓、NaOH+CO2=NaHCO3,沉淀F是Al(OH)3,滤液E中成分是NaHCO3和Na2SO4,将沉淀氢氧化铝加热得到Al2O3,电解熔融Al2O3得到Al,
A.通过以上分析知,沉淀A主要是SiO2,故A正确;
B.步骤②发生的反应为Fe2(SO4)3+6NaOH=3Na2SO4+2 Fe(OH)3↓、Al2(SO4)3+8NaOH=3 Na2SO4+2NaAlO2+4H2O,所以目的是分离Fe3+和Al3+,故B正确;
C.溶液E溶质主要有碳酸氢钠和硫酸钠,故C错误;
D.电解过程中是将电能转化为化学能,故D正确;
故选C.
点评 本题以金属冶炼为载体考查物质分离和提纯,侧重考查元素化合物性质,明确物质性质差异性是解本题关键,知道流程图中发生的反应及溶液、沉淀成分,易错点是偏铝酸钠和二氧化碳反应方程式的书写,易错选项是C,很多同学往往漏掉硫酸钠而导致错误,题目难度中等.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案
| A. | 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 | |
| B. | 1mol该化合物最多可以与4molNaOH反应 | |
| C. | 既可以催化加氢,又可以使酸性KMnO4溶液褪色 | |
| D. | 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
| A. | 1:1 | B. | 1:2 | C. | 3:4 | D. | 1:8 |
①分子晶体中一定都存在共价键
②在晶体中只要有阴离子就一定有阳离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中可能含有共价键,但一定含有金属元素
⑤晶格能由大到小顺序:MgO>NaF>NaCl>NaBr
⑥在NaCl晶体中,与一个Na+最近且距离相等的Na+是6个.
| A. | ①②③⑥ | B. | ①②④ | C. | ③⑤⑥ | D. | ②③⑤ |
C(s)+H2O(g)=CO(g)+H2(g)△H=+130kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-220kJ•mol-1
H-H、O=O键能分别为436、496kJ•mol-1,则O-H键能为( )
| A. | 222 kJ•mol-1 | B. | 444 kJ•mol-1 | C. | 462 kJ•mol-1 | D. | 924 kJ•mol-1 |
| A. | NO2 | B. | BF3 | C. | PCl3 | D. | H3O+ |
 .原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
.原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.


