题目内容
【题目】碳酸氢铵是我国主要的氮肥品种之一,在贮存和运输过程中容易挥发损失。为了鉴定其质量和确定田间施用量,必须测定其含氮量。
I.某学生设计了一套以测定二氧化碳含量间接测定含氮量的方法。将样品放入圆底烧瓶中:
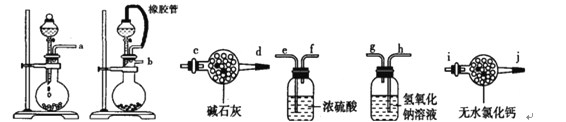
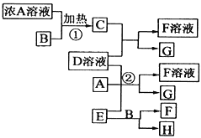
(1)请选择必要地装置,按气流方向连接顺序为________________。
(2)分液漏斗中的液体最适合的是___________。
A.稀盐酸 B.稀硫酸 C.浓硝酸 D.氢氧化钠
(3)连在最后的装置起到的作用____________________________________。
Ⅱ.如果氮肥中成分是(NH4)2SO4,则可以用甲醛法测定含氮量。甲醛法是基于甲醛与一定量的铵盐作用,生成相当量的酸,反应为2(NH4)2SO4+6HCHO→(CH2)6N4 +2H2SO4 + 6H2O,生成的酸再用氢氧化钠标准溶液滴定,从而测定氮的含量。步骤如下:
(4)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液。用________准确取出20.00mL的溶液于锥形瓶中,加入18%中性甲醛溶液5mL,放置5min后,加入1~2滴________指示剂(已知滴定终点的pH约为8.8),用浓度为0.08mol/L氢氧化钠标准溶液滴定,读数如下表:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 1.20 | 16.21 |
2 | 3.00 | 18.90 |
3 | 4.50 | 19.49 |
达滴定终点时的现象为______________________________,由此可计算出该样品中的氮的质量分数为_________________。
(5)在滴定实验结束后发现滴定用的滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值________(填“偏大”“偏小”或“无影响”)。
【答案】b-e,f-h,g-c B 防止空气中水和二氧化碳进入装置影响实验结果 滴定管 酚酞 溶液从无色变为浅红色 ,30s内不褪色 14% 偏小
【解析】
根据反应装置-干燥装置-吸收装置-尾气处理装置排序;盐酸和硝酸都具有挥发性;空气中的水和二氧化碳影响实验结果;酸式滴定管只能量取酸性溶液,碱式滴定管只能量取碱性溶液,根据溶液的酸碱性确定滴定管;根据滴定终点确定指示剂;滴定终点时溶液从无色变为浅红色,30s内不褪色;根据氢氧化钠和硫酸铵的关系式计算硫酸铵的量,最后再计算N元素的含量;在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,导致硫酸铵的测定结果偏小。据此分析。
(1)根据反应装置、干燥装置、吸收装置、尾气处理装置排序,所以其排列顺序是:b-e,f-h,g-c,答案为:b-e,f-h,g-c;
(2)制取二氧化碳时需要碳酸盐和酸反应,稀盐酸、浓硝酸都具有挥发性,影响实验结果,氢氧化钠和盐不能生成二氧化碳,所以B选项是正确的,答案为:B;
(3)为防止影响实验结果需要吸收二氧化碳和水蒸气,答案为:防止空气中水和二氧化碳进入装置影响实验结果;
(4)硫酸铵属于强酸弱碱盐,铵根离子水解使溶液呈酸性,所以需要酸式滴定管量取硫酸铵溶液,滴定终点的pH约为8.8,酚酞的变色范围是8-10,所以选取酚酞作指示剂;滴定终点时,溶液从无色变为浅红色,30s内不褪色;2(NH4)2SO4+6HCHO=(CH2)6N4+2H2SO4+6H2O, 2NaOH+H2SO4=Na2SO4+2H2O,所以硫酸铵和NaOH的关系式为:(NH4)2SO4![]() 2NaOH,NaOH溶液的平均体积为
2NaOH,NaOH溶液的平均体积为![]() ,根据(NH4)2SO4
,根据(NH4)2SO4![]() 2NaOH得硫酸铵的质量
2NaOH得硫酸铵的质量![]() ,0.6g硫酸铵中样品中硫酸铵的质量为
,0.6g硫酸铵中样品中硫酸铵的质量为![]() ,氮元素的质量分数为
,氮元素的质量分数为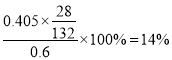 ;答案为:酸式滴定管;酚酞;从无色变为浅红色,30s内不褪色;14%;
;答案为:酸式滴定管;酚酞;从无色变为浅红色,30s内不褪色;14%;
(5)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,导致NaOH溶液的量偏小,根据(NH4)2SO4![]() 2NaOH得,导致测定N含量偏小,答案为:偏小。
2NaOH得,导致测定N含量偏小,答案为:偏小。

 阅读快车系列答案
阅读快车系列答案【题目】氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl、NHCl2和NCl3),副产物少于其它水消毒剂。回答下列问题:
(1)①一氯胺(NH2Cl)的电子式为 ________________ 。
②工业上可利用反应Cl2(g)+NH3(g)=NH2Cl(g)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的键能相同),则该反应的△H=________。
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能(kJ/mol) | 391 | 243 | 191 | 431 |
③一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌消毒作用的物质,该反应的化学方程式为_________________________________。
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①甲容器中,0~40 min内用NH3的浓度变化表示的平均反应速率v(NH3)=___________。
②该反应的△H________0(填“>”或“<”) 。
③对该反应,下列说法正确的是______________(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内Cl2和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中充入一定量氦气,Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NHCl2,平衡向逆反应方向移动
(3)在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:

①A、B、C三点中Cl2转化率最高的是______点(填“A”“B”或“C”)。(提示:C点时HCl和Cl2的浓度相等)
②计算C点时该反应的压强平衡常数Kp(C)=_________(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)