题目内容
【题目】乙烯与乙烷混合气体共a mol,与b mol的氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g水。试求:
(1) 当a=1时,乙烯和乙烷的物质的量之比n(C2H4):n(C2H6)=________________________;
(2) 当a=1时,且反应后CO和CO2混合气体的物质的量为反应前氧气的2/3时,则b=_________,得到的CO和CO2的物质的量之比n(CO):n(CO2)=______________。
(3) a的取值范围是____________________;b的取值范围是_________________________。
【答案】1∶1 3 1∶3 ![]()
![]()
【解析】
(1)设乙烯和乙烷的物质的量分别是x和y,则x+y=1、2x+3y=45÷18=2.5,解得x=y=0.5,所以乙烯和乙烷的物质的量之比n (C2H4)∶n (C2H6)=1∶1。
(2)设CO和CO2的物质的量分别是x和y,则根据碳原子守恒可知x+y=2。根据氧原子守恒可知(x+2y+2.5)÷2即是反应前氧气的物质的量,所以有x+y=(x+2y+2.5)÷3。解得x=0.5mol、y=1.5mol,则得到的CO和CO2的物质的量之比n (CO)∶n (CO2)=1∶3。所以b=(x+2y+2.5)÷2=3mol。
(3)由于水是2.5mol,所以如果全部是乙烯生成的,则a=![]() ;如果全部是乙烷生成的,则a=
;如果全部是乙烷生成的,则a=![]() ,因此a的取值范围是
,因此a的取值范围是![]() 。
。
(4)根据(3)可知,如果全部是乙烯生成的,则a=![]() ,则需要氧气的物质的量是
,则需要氧气的物质的量是![]() ;如果全部是乙烷生成的,则a=
;如果全部是乙烷生成的,则a=![]() ,则需要氧气的物质的量是
,则需要氧气的物质的量是![]() ,因此b的取值范围是
,因此b的取值范围是![]() 。
。

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案【题目】碳酸氢铵是我国主要的氮肥品种之一,在贮存和运输过程中容易挥发损失。为了鉴定其质量和确定田间施用量,必须测定其含氮量。
I.某学生设计了一套以测定二氧化碳含量间接测定含氮量的方法。将样品放入圆底烧瓶中:
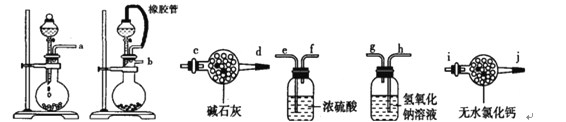
(1)请选择必要地装置,按气流方向连接顺序为________________。
(2)分液漏斗中的液体最适合的是___________。
A.稀盐酸 B.稀硫酸 C.浓硝酸 D.氢氧化钠
(3)连在最后的装置起到的作用____________________________________。
Ⅱ.如果氮肥中成分是(NH4)2SO4,则可以用甲醛法测定含氮量。甲醛法是基于甲醛与一定量的铵盐作用,生成相当量的酸,反应为2(NH4)2SO4+6HCHO→(CH2)6N4 +2H2SO4 + 6H2O,生成的酸再用氢氧化钠标准溶液滴定,从而测定氮的含量。步骤如下:
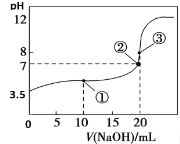
(4)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液。用________准确取出20.00mL的溶液于锥形瓶中,加入18%中性甲醛溶液5mL,放置5min后,加入1~2滴________指示剂(已知滴定终点的pH约为8.8),用浓度为0.08mol/L氢氧化钠标准溶液滴定,读数如下表:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 1.20 | 16.21 |
2 | 3.00 | 18.90 |
3 | 4.50 | 19.49 |
达滴定终点时的现象为______________________________,由此可计算出该样品中的氮的质量分数为_________________。
(5)在滴定实验结束后发现滴定用的滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值________(填“偏大”“偏小”或“无影响”)。