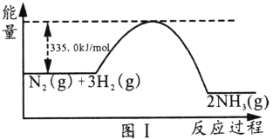
题目内容
【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的两个反应:
反应I: CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g) ![]() H1
H1
反应II:CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g)
CH3OH(g)+ H2O(g) ![]() H2
H2
①上述反应符合“原子经济”原则的是____________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为______________热反应(填“吸”或“放”)。
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分发生反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为_______,此时的温度为_______(从表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ![]() H1kJ/mol
H1kJ/mol
②2CO(g)+O2(g)=2CO2(g) ![]() H2kJ/mol
H2kJ/mol
③H2O(g)=H2O(l) ![]() H3 kJ/mol
H3 kJ/mol
则反应 CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l) ![]() H=________kJ/mol
H=________kJ/mol
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法:
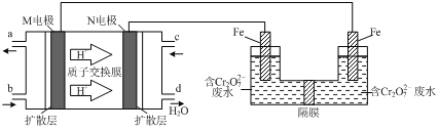
①N电极的电极反应式为____________。
②请完成电解池中Cr2O72-转化为Cr3+的离子反应方程式:
Cr2O72-+_______Fe2+ +________ [___]═ ________Cr3++_______Fe3++_________[___]
【答案】Ⅰ 放 80% 250℃ ![]() O2+4e-+4H+=2H2O 6 14 H+ 2 6 7 H2O
O2+4e-+4H+=2H2O 6 14 H+ 2 6 7 H2O
【解析】
(1)①“原子经济”是指在化学品合成过程中,所用的所有原材料尽可能多的转化到最终产物中,原子利用率为100%最经济;
②由表中数据可知,随温度升高平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应;
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,根据化学反应过程中各物质浓度变化之比等于其化学计量数之比计算平衡时各物质的浓度,然后计算CO转化率,根据平衡常数的定义计算该温度下的平衡常数,进而判断温度;
(2)利用盖斯定律构造目标热化学方程式并求焓变;
(3)①氢离子由质子交换膜由M电极区移向N电极区,则M为负极、N为正极,负极上发生氧化反应,甲醇失去电子,生成二氧化碳与氢离子,正极发生还原反应,氧气获得电子,与通过质子交换膜的氢离子结合为水;
②根据氧化还原反应得失电子守恒、电荷守恒、原子守恒配平。
(1)①反应I中所用原材料原子均转化到最终产物中,原子利用率为100%最经济,反应Ⅰ符合“原子经济”,故答案为:Ⅰ;
②由表数据可知,温随温度升高平衡常数减小,说明升高温度平衡向逆反应方向移动,则逆向是吸热反应,故正向放热反应;
③CO的起始浓度为1mol/L、H2的起始浓度为3mol/L,平衡时c(CO)=0.2mol/L,则△c(CO)=1mol/L0.2mol/L=0.8mol/L,由方程式可知△c(H2)=2△c(CO)=1.6mol/L,故平衡时H2的浓度为3mol/L1.6mol/L=1.4mol/L,平衡时c(CH3OH)=△c(CO)=0.8mol/L,CO的转化率=![]() =80%;平衡常数
=80%;平衡常数![]() ,所以温度为250℃;
,所以温度为250℃;
(2)根据盖斯定律![]() (①②+4×③)可得:CH3OH(l)+O2(g)=CO(g)+2H2O(l)ΔH=
(①②+4×③)可得:CH3OH(l)+O2(g)=CO(g)+2H2O(l)ΔH=![]() kJ/mol;
kJ/mol;
(3)①由上述分析可知,N电极上氧气获得电子,与通过质子交换膜的氢离子结合为水,其电极反应式为:O2+4e-+4H+=2H2O;
②电解池溶液里![]() 转化为Cr3+,化合价降低共6价,左侧Fe电极为阳极,Fe失去电子生成Fe2+,酸性条件Fe2+
转化为Cr3+,化合价降低共6价,左侧Fe电极为阳极,Fe失去电子生成Fe2+,酸性条件Fe2+![]() 还原为Cr3+,自身被氧化为Fe3+,化合价升高共1价,化合价升降最小公倍数为6,则
还原为Cr3+,自身被氧化为Fe3+,化合价升高共1价,化合价升降最小公倍数为6,则![]() 的系数为1,Fe2+的系数为6,再结合电荷守恒、原子守恒配平方程式为:
的系数为1,Fe2+的系数为6,再结合电荷守恒、原子守恒配平方程式为:![]() 。
。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】能源开发、环境保护、资源利用等是当今社会的热门话题。请根据所学化学知识回答下列问题:
(1)汽车上安装催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g) + O2(g)=2NO(g) △H=+180.5 kJ · mol-1;
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ · mol-1;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ · mol-1;
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________。
(2)汽车尾气分析仪对CO的含量分析是以燃料电池为工作原理,其装置如下图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质中自由移动。

下列说法中正确的是_____________(填字母序号)。
A.负极的电极反应式为:CO + O2-―2e-=CO2
B.工作时电子由电极a通过传感器流向电极b
C.工作时电极b作正极,O2-由电极a通过固体介质向电极b迁移
D.传感器中通过的电流越大,尾气中CO的含量越高
(3)某硝酸厂利用甲醇处理废水。在一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比为______________。
(4)煤的间接液化是先转化为CO和H2,再在催化剂作用下合成甲醇。若在一定温度下,向1 L密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
物 质 | CO | H2 | CH3OH |
浓度/(mol·L-1) | 1.2 | 1.0 | 0.6 |
①该反应的平衡常数表达式为:K=_____________________。
②该时间内反应速率υ(H2)=_________________。
③平衡时CO的转化率为_________________(保留1位小数)。
【题目】用如图所示装置检验乙烯时不需要虚线框中除杂装置的是( )

选项 | 乙烯的制备 | 试剂X | 试剂Y |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | I2的CCl4溶液 |
C | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | I2的CCl4溶液 |
A.AB.BC.CD.D