题目内容
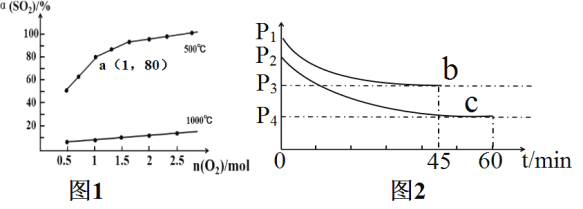
【题目】催化氧化反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0。在体积可变的密闭容器中,维持压强为1.01×105Pa,充入2molSO2和一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
2SO3(g) △H<0。在体积可变的密闭容器中,维持压强为1.01×105Pa,充入2molSO2和一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
已知反应aA(g)+bB(g)![]() gG(g)+hH(g)的标准平衡常数Kθ=
gG(g)+hH(g)的标准平衡常数Kθ= ,其中Pθ=1.01×105Pa,PG,PH,PA,PB分别表示G,H,A,B的分压,P(分压)=P(总压)×物质的量分数。
,其中Pθ=1.01×105Pa,PG,PH,PA,PB分别表示G,H,A,B的分压,P(分压)=P(总压)×物质的量分数。
(1)在绝热恒容的密闭容器中,能表明反应2SO2(g)+O2(g)![]() 2SO3(g)已达到平衡状态的是___。
2SO3(g)已达到平衡状态的是___。
A.v(SO2)=2v(O2)
B.当容器内温度不再变化时
C.各组分的物质的量相等
D.容器内气体密度不变
E.混合气体的平均相对分子质量不变
(2)在1000℃时随着O2物质的量的增大,但SO2平衡转化率升高缓慢,其原因是___。
(3)求图1中a点的标准平衡常数Kθ=___。在a点达到平衡后,若保持温度、压强不变,再向体系中充入SO2(g),O2(g),SO3(g)各0.2mol时,此时v(正)___v(逆)(填“<”“>”或“=”)。
(4)若在相同的恒容密闭容器中充入O2和SO2各2mol,在不同温度下达到平衡,反应体系总压强随时间变化如图2所示,则达到平衡状态b和c时,SO3体积分数较大的是___(填“b”或“c”),原因是___。
【答案】BE 1000℃时,该反应平衡常数很小,SO2平衡转化率的变化很小 176 > c 起始b压强大于c说明b温度高于c,该反应是放热反应,温度越低平衡时SO3的体积分数越大
【解析】
(1)根据平衡状态的本质及特征分析解答;
(2)根据温度对平衡常数及平衡移动方向的影响分析解答;
(3)根据题给信息中平衡常数的表达式计算平衡常数,判断平衡移动方向;
(4)实验b到达平衡时总压强变大,说明平衡逆向移动,而化学反应速率变大,考虑到该反应是放热反应,可能是升高温度所导致。
(1)A. v(SO2)=2v(O2)并未体现正反应速率与逆反应速率的相对大小,不能说明反应已经达到平衡,故A不选;
B. 该容器为绝热容器,当容器内温度不再变化时,说明正反应速率等于逆反应速率,能说明反应已经达到平衡,故B选;
C. 各组分的物质的量相等不能说明各组分的浓度不再变化,也就不能说明反应达到平衡,故C不选;
D. 容器体积不变,且反应前后气体质量不变,所以容器内气体密度始终不变,不能说明反应达到平衡,故D不选;
E. 反应前后气体总质量不变,反应前后气体的总物质的量不相等,则混合气体的平均相对分子质量不变时,说明各组分的浓度不变,能说明反应已经达到平衡,故E选,故答案为:BE;
(2)2SO2(g)+O2(g)2SO3(g)△H<0,温度达到1000℃时该反应的平衡常数很小,使二氧化硫的平衡转化率小,在1000℃时,恒压条件下,充入氧气,c(SO2)和c(SO3)等倍数减小,c(O2)增大,Qc=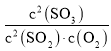 <K,平衡正向移动,二氧化硫的平衡转化率增大,但变化很小,故答案为:1000℃时,该反应平衡常数很小,SO2平衡转化率的变化很小;
<K,平衡正向移动,二氧化硫的平衡转化率增大,但变化很小,故答案为:1000℃时,该反应平衡常数很小,SO2平衡转化率的变化很小;
(3)a点达到平衡时,SO2的物质的量为2mol×(1-80%)=0.4mol,则
SO2,O2,SO3的分压分别为:1.01×105Pa×![]() =1.01×105Pa×
=1.01×105Pa×![]() 、1.01×105Pa×
、1.01×105Pa×![]() 、1.01×105Pa×
、1.01×105Pa×![]() ,则Kθ=
,则Kθ=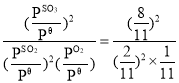 =176;再向体系中充入SO2(g),O2(g),SO3(g)各0.2mol时,SO2,O2,SO3的分压分别为:1.01×105Pa×
=176;再向体系中充入SO2(g),O2(g),SO3(g)各0.2mol时,SO2,O2,SO3的分压分别为:1.01×105Pa×![]() =1.01×105Pa×
=1.01×105Pa×![]() 、1.01×105Pa×
、1.01×105Pa×![]() 、1.01×105Pa×
、1.01×105Pa×![]() ,Qp=
,Qp=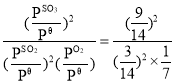 =63<Kθ,平衡向正向移动,v(正) >v(逆),故答案为:176;>;
=63<Kθ,平衡向正向移动,v(正) >v(逆),故答案为:176;>;
(4)如图所示,达到平衡状态b和c时,SO3体积分数较大的是c;原因是起始b压强大于c说明b温度高于c,该反应是放热反应,温度越低平衡时SO3的体积分数越大,故答案为:c;起始b压强大于c说明b温度高于c,该反应是放热反应,温度越低平衡时SO3的体积分数越大。

【题目】在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____________。
(2)该反应为______反应(选填吸热、放热)。
升高温度CO2的转化将____________(填增大、减小或不变)。
(3)能判断该反应是否达到化学平衡状态的依据是______(多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______℃。