题目内容
【题目】在不同温度下,水溶液中![]() 与
与![]() 关系如图所示。下列说法不正确的是
关系如图所示。下列说法不正确的是![]()
![]()
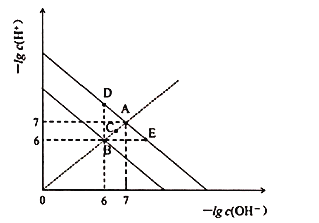
A.图中五点![]() 间的关系:
间的关系:![]()
B.![]() 点对应的水溶液中,可能有
点对应的水溶液中,可能有![]() 、
、![]() 、
、![]() 、
、![]() 大量同时存在
大量同时存在
C.若![]() 的NaHA溶液水溶液中
的NaHA溶液水溶液中![]() 与
与![]() 关系如图D点所示,则溶液中有:
关系如图D点所示,则溶液中有:![]()
D.向![]() 溶液中滴入
溶液中滴入![]() 溶液,当
溶液,当![]() 与
与![]() 关系如图E点所示,则溶液中反应:
关系如图E点所示,则溶液中反应:![]()
【答案】C
【解析】
由图象可知,A、E、D都为![]() 时的曲线上,水的Kw只与温度有关,温度相同时Kw相同,温度升高,促进水的电离,Kw增大,水的离子积只与温度有关,与溶液的类型无关,可能为纯水,也可能为酸、碱、盐溶液,据此分析解答。
时的曲线上,水的Kw只与温度有关,温度相同时Kw相同,温度升高,促进水的电离,Kw增大,水的离子积只与温度有关,与溶液的类型无关,可能为纯水,也可能为酸、碱、盐溶液,据此分析解答。
A.由图象可知,A、E、D都为![]() 时的曲线上,水的Kw只与温度有关,温度相同时Kw相同,温度升高,促进水的电离,Kw增大,则
时的曲线上,水的Kw只与温度有关,温度相同时Kw相同,温度升高,促进水的电离,Kw增大,则![]() ,由C点
,由C点![]() 可知,C点的Kw大于A点小于B,所以
可知,C点的Kw大于A点小于B,所以![]() ,故A正确;
,故A正确;
B.E点![]() ,溶液呈酸性,酸性条件下,
,溶液呈酸性,酸性条件下,![]() 、
、![]() 、
、![]() 、
、![]() 没有沉淀、气体、弱电解质、氧化还原反应产生,所以能共存,故B正确;
没有沉淀、气体、弱电解质、氧化还原反应产生,所以能共存,故B正确;
C.D点溶液中![]() ,溶液呈碱性,说明
,溶液呈碱性,说明![]() 的水解程度大于电离程度,所以
的水解程度大于电离程度,所以![]() ,故C错误;
,故C错误;
D.E点![]() ,溶液呈酸性,向
,溶液呈酸性,向![]() 溶液中滴入
溶液中滴入![]() 溶液,则溶液中反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D正确;
溶液,则溶液中反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D正确;
故选C。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____________。
(2)该反应为______反应(选填吸热、放热)。
升高温度CO2的转化将____________(填增大、减小或不变)。
(3)能判断该反应是否达到化学平衡状态的依据是______(多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______℃。