题目内容
【题目】氨氮是水体中氮的主要形态之一,氨氮含量过高对水中生物会构成安全威胁。
(1)一定条件下,水中的氨氮可以转化为氮气而除去。
已知:2NH4+(aq)+3O2(g)=2NO2-(aq)+2H2O(l)+4H+(aq) ΔH=a kJ·mol-1
2NO2-(aq)+O2(g)=2NO3-(aq) ΔH=b kJ·mol-1
5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) ΔH=c kJ·mol-1
则4NH4+(aq)+3O2(g)=2N2(g)+6H2O(l)+4H+(aq) ΔH=________kJ·mol-1。
(2)实验室用电解法模拟处理氨氮废水。电解时,不同氯离子浓度对溶液中剩余氨氮浓度的影响如图所示。增大氯离子浓度可使氨氮去除率____(填“增大”、“减小”或“不变”),其原因是阳极生成强氧化性气体,则阳极电极反应为_______。

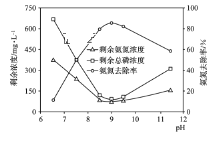
(3)化学沉淀法是一种处理高浓度氨氮废水的有效方法。通过加入MgCl2和Na2HPO4将NH4+转化为MgNH4PO4·6H2O沉淀除去。25 ℃时,在氨氮初始质量浓度400 mg·L-1、n(Mg)∶n(P)∶n(N)=1∶1∶1的条件下,溶液pH对氨氮去除率及剩余氨氮浓度和总磷浓度的影响如图所示。
①反应生成MgNH4PO4·6H2O沉淀的离子方程式为______________。
②该实验条件下,控制溶液的适宜pH范围为________;当pH>9时,溶液中总磷浓度随pH增大而增大的主要原因是_________(用离子方程式表示)。
【答案】![]() 增大 2Cl--2e-=Cl2↑ HPO42-+Mg2++NH4++6H2O=MgNH4PO4·6H2O↓+H+ 8.5<pH<9.5 MgNH4PO4+2OH-=Mg(OH)2+NH4++PO43-[或MgNH4PO4+3OH-=Mg(OH)2+NH3·H2O+PO43-]
增大 2Cl--2e-=Cl2↑ HPO42-+Mg2++NH4++6H2O=MgNH4PO4·6H2O↓+H+ 8.5<pH<9.5 MgNH4PO4+2OH-=Mg(OH)2+NH4++PO43-[或MgNH4PO4+3OH-=Mg(OH)2+NH3·H2O+PO43-]
【解析】
(1)根据盖斯定律计算反应的焓变;
(2)根据图象分析,Cl-浓度增大,氨氮去除率增大,电解池中Cl-转化为Cl2,Cl2能氧化NH4+达到去除的目的;
(3)①MgCl2、Na2HPO4和NH4+反应生成MgNH4PO46H2O沉淀,据此写出反应的方程式;
②根据图象分析,当控制pH在8.5~9.5范围内,氨氮去除率较高,pH范围在9~11时,溶液中总磷浓度随pH增大而增大,考虑溶液碱性增强,MgNH4PO4在碱性条件下转化为Mg(OH)2和PO43-,导致溶液中总磷浓度增大。
(1)已知:①2NH4+(aq)+3O2(g)=2NO2-(aq)+2H2O(l)+4H+(aq) ΔH1=a kJ·mol-1
②2NO2-(aq)+O2(g)=2NO3-(aq) ΔH2=b kJ·mol-1
③5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) ΔH3=c kJ·mol-1
将![]() ,整理可得反应方程式为:4NH4+(aq)+3O2(g)=2N2(g)+6H2O(l)+4H+(aq) ΔH=
,整理可得反应方程式为:4NH4+(aq)+3O2(g)=2N2(g)+6H2O(l)+4H+(aq) ΔH=![]() kJ/mol;
kJ/mol;
(2)根据图象分析,Cl-浓度增大,氨氮去除率增大,电解池中Cl-转化为Cl2,Cl2能够将NH4+氧化为氮气(或NO3-)而除去,阳极的电极反应式为:2Cl--2e-=Cl2↑;
(3)①MgCl2、Na2HPO4和NH4+反应生成MgNH4PO46H2O沉淀,所以发生的反应为:HPO42-+Mg2++NH4++6H2O=MgNH4PO4·6H2O↓+H+;
②根据图象分析,当控制pH在8.5~9.5范围内,氨氮去除率较高,当pH范围在9~11时,溶液中总磷浓度随pH增大而增大,考虑溶液碱性增强,MgNH4PO4在碱性条件下转化为Mg(OH)2和PO43-,导致溶液中总磷浓度增大,发生的反应为:MgNH4PO4+2OH-=Mg(OH)2+NH4++PO43-[或MgNH4PO4+3OH-=Mg(OH)2+NH3·H2O+PO43-]。