��Ŀ����
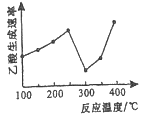
����Ŀ��2SO2(g)+O2(g) =2SO3(g)��Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2(g)����Ϊ1mol SO3����H=-99kJ��mol-1.��ش��������⣺

��1��ͼ��A��C�ֱ��ʾ______��______��E�Ĵ�С�Ը÷�Ӧ�ķ�Ӧ������Ӱ�죿_______���÷�Ӧͨ����V2O5����������V2O5��ʹͼ��B�������ǽ��ͣ�________��������________________________��
��2��ͼ����H=__KJ��mol-1��
��3����֪�������ȼ����Ϊ296 KJ��mol-1��������S(s)����3 molSO3(g)����H__��Ҫ��д������̣���
���𰸡���Ӧ������ ���������� �� ���� ��Ϊ�����ı��˷�Ӧ������ʹ���E���� -198 ��1185 KJ��mol-1
��������
��1������ͼ���ص�ͷ���ʽ��֪��A��ʾ��Ӧ�����������C��ʾ���������������E��ʾ��ܣ����С�ͷ�Ӧ�����صġ������ܽ��ͷ�Ӧ�Ļ�ܣ��Ӷ��ӿ췴Ӧ���ʡ�
��2��ͼ���ʾ��������2molSO3ʱ��Ӧ�����е������仯�������H����2��99kJ/mol����198 kJ/mol��
��3����ȼ�յ��Ȼ�ѧ����ʽΪS(s)+O2(g) =2SO2(g) ��H1=-296KJ��mol-1����֪ SO2(g)+1/2O2(g) =SO3(g) ��H2=-99 KJ��mol-1���ݸ�˹���ɿ�֪��3 S(s)+9/2O2(g)=3SO3(g) ��H=3(��H1+��H2)= ��1185 kJ/mol��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�