题目内容
14.以食盐为原料进行生产并综合利用的某些过程如图所示: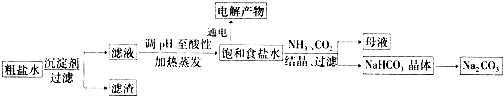
(1)为除去粗盐中的Ca2+、Mg2+和SO42-,得到纯净的NaCl晶体,需加入以下试剂:a.过量的NaOH溶液;b.过量的Na2CO3溶液;c.适量的盐酸;d.过量的BaCl2溶液.
正确的加入顺序是adbc,还缺少的操作步骤是过滤和蒸发结晶.
(2)将滤液的pH调至酸性除去的离子是OH-、CO32-,发生反应的离子方程式为H++OH-=H2O、CO32-+2H+=CO2↑+H2O.
(3)若用惰性电极电解200mL1.5mol/L食盐水,当电解2min时,两极共收集到448mL气体(标准状况下).假设电解前后溶液的体积不变,则电解后该溶液的pH为13.
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是NH3.
(5)纯碱在生产生活中有广泛的应用.
①纯碱可用于除灶台油污.其原因是(结合离子方程式表述)Na2CO3溶液显碱性,即CO32-+H2O
 HCO3-+OH-,与油污发生反应,达到去污目的.
HCO3-+OH-,与油污发生反应,达到去污目的.②常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13.
则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是1010.
分析 根据流程可知,粗盐水加入沉淀剂过滤得到滤液,加入试剂调节溶液PH至酸性,加热蒸发得到饱和食盐水,电解生成氢氧化钠、氯气和氢气,加入碳酸铵反应生成碳酸氢钠晶体和氯化铵溶液,碳酸氢钠晶体加热分解得到碳酸钠,母液中加入过量生石灰生成氨气回收循环使用,
(1)根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析;
(2)将滤液的pH值调至酸性,目的是除去粗盐提纯过程中加入的盐酸,和少量碳酸钠;
(3)结合反应过程和电极反应,计算溶液中氢离子浓度得到溶液pH;
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,和氯化铵反应生成氨气,可以循环使用;
(5)①根据纯碱的性质来分析原因及书写化学方程式;
②氢氧化钠中氢氧根离子是完全是水电离出的,碳酸钠溶液中氢氧根离子是水完全电离生成的,结合离子积计算判断.
解答 解:(1)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,在进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,通过蒸发结晶得到纯净的NaCl晶体,所以正确的顺序为:adbc,缺少的步骤为过滤、蒸发结晶,
故答案为:adbc;过滤;蒸发结晶;
(2)将滤液的pH值调至酸性,目的是除去粗盐提纯过程中加入的盐酸,和少量碳酸钠;除去的离子是OH-,CO32-;反应的离子方程式为:H++OH-=H2O,CO32-+2H+=CO2↑+H2O;
故答案为:OH-、CO32-;H++OH-=H2O、CO32-+2H+=CO2↑+H2O;
(3)若用惰性电极电解200mL 1.5mol•L-1食盐水,n(NaCl)=0.2L×1.5mol/L=0.3mol,当电解2min时,两极共收集到448mL气体(标准状态下),n=$\frac{0.448L}{22.4L/mol}$=0.02mol,2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,生成氢气为0.01mol,溶液中增加氢氧根离子物质的量为0.02mol,假设电解前后溶液的体积不变,$\frac{0.02mol}{0.2L}$=0.1mol/mol,氢氧根离子浓度=结合离子积常数计算得到溶液中氢离子浓度=$\frac{1{0}^{-14}}{0.1}$=10-13mol/L,则电解后该溶液的pH为13;
故答案为:13;
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,反应生成的氢氧化钙和氯化铵反应生成氨气,可以循环使用,
故答案为:NH3;
(5)①纯碱即Na2CO3可用于除灶台油污,其原因是Na2CO3溶液显碱性,即CO32-+H2O HCO3-+OH-,与油污发生反应,达到去污目的;
HCO3-+OH-,与油污发生反应,达到去污目的;
故答案为:Na2CO3溶液显碱性,即CO32-+H2O HCO3-+OH-,与油污发生反应,达到去污目的;
HCO3-+OH-,与油污发生反应,达到去污目的;
②pH为11碳酸钠溶液中:c(H+)剩余•c(OH-)水=10-14;c(OH-)水=10-3mol/L,Na2CO3溶液中加入过量石灰乳,反应生成碳酸钙和氢氧化钠,所得溶液pH=13,则此时水电离出的c(OH-)的值是10-13mol/L,
所以反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值=$\frac{1{0}^{-3}mol/L}{1{0}^{-13}mol/L}$=1010,
故答案为:1010.
点评 本题考查了化学实验基本操作方法的综合应用及盐的水解原理,题目难度中等,涉及粗盐提纯、盐的水解原理影响及其应用、溶液pH的计算、化学实验基本操作方法的应用等知识,注意掌握盐的水解原理及溶液pH的计算方法,明确粗盐提纯原理及操作方法.

| A. | 右;( M+2Q) | B. | 右;(M+4Q ) | C. | 左;(M+2Q) | D. | 左;(M+4Q) |
| A. | N5+离子中含有36个电子 | B. | O2与O4属于同位素 | ||
| C. | C60是有机物 | D. | H2与H3属于同种元素组成的单质 |
| A. | 钠在空气中易被氧化,需将其保存在酒精中 | |
| B. | 能使润湿的红色石蕊试纸变成蓝色的气体一定是NH3 | |
| C. | 向某有色溶液中通入SO2气体,溶液变为无色,证明SO2具有漂白性 | |
| D. | 向某溶液中加入BaCl2溶液,产生能溶于稀盐酸的白色沉淀,该溶液一定含有CO32- |
Ⅰ.起始浓度 N2:l mol•L -1,H2:3mol•L -1
Ⅱ.起始浓度 N2:2mol•L -1,H2:6mol•L -1
则下列叙述正确的是( )
| A. | Ⅰ和II两途径达到平衡时,体系内各成分的体积分数相同 | |
| B. | 达到平衡时,Ⅰ途径的反应速率v(H2)等于Ⅱ途径的反应速率v(H2) | |
| C. | 达到平衡时,Ⅱ途径体系内混合气体的压强是Ⅰ途径内混合气体压强的2倍 | |
| D. | 达到平衡时,Ⅰ途径体系内混合气体的密度为途径Ⅱ体系内混合气体的密度的$\frac{1}{2}$ |
| A. | 甲烷的二氯代物有两种 | |
| B. | 等物质的量的乙醇和乙烯完全燃烧消耗氧气的质量不同 | |
| C. | 葡萄糖能发生银镜反应,也能与氧气发生催化氧化反应 | |
| D. | 向蛋白质溶液中加入CuSO4溶液后能发生盐析 |
| A. | 14C原子结构示意图: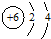 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | CO2的电子式: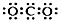 | D. | CH4分子的球棍模型: |
| A. | 在Na2S稀溶液中:c (Na+)>c (S2-)>c (OH-)>c (H+)>c (HS-) | |
| B. | 在Na2C2O4稀溶液中:c (Na+)+c (H+)=c (OH-)+c (C2O42-)+c (HC2O4-) | |
| C. | 在含等物质的量的Na2CO3和NaHCO3的混合溶液中:3 c (Na+)=2[c (CO32-)+c (HCO3-)+c (H2CO3)] | |
| D. | 在NaHSO3稀溶液中:c (OH-)+c (SO32-)=c (H+)+c (H2SO3) |