题目内容
2.下列叙述中正确的是( )| A. | 钠在空气中易被氧化,需将其保存在酒精中 | |
| B. | 能使润湿的红色石蕊试纸变成蓝色的气体一定是NH3 | |
| C. | 向某有色溶液中通入SO2气体,溶液变为无色,证明SO2具有漂白性 | |
| D. | 向某溶液中加入BaCl2溶液,产生能溶于稀盐酸的白色沉淀,该溶液一定含有CO32- |
分析 A.钠与乙醇反应;
B.能使润湿的红色石蕊试纸变成蓝色,该气体为碱性气体;
C.二氧化硫能够使高锰酸钾褪色,体现还原性;
D.亚硫酸根离子与钡离子生成的亚硫酸钡也能溶于盐酸.
解答 解:A.钠与乙醇反应,不能保存在乙醇中,故A错误;
B.氨气是碱性其气体,能够能使润湿的红色石蕊试纸变成蓝色,故B正确;
C.二氧化硫能够使高锰酸钾褪色,体现还原性,不体现漂白性,故C错误;
D.向某溶液中加入BaCl2溶液,产生能溶于稀盐酸的白色沉淀,该溶液可能含有碳酸根离子或者亚硫酸根离子,故D错误;
故选:B.
点评 本题考查了元素化合物知识,熟悉钠、二氧化硫、氨气的性质是解题关键,注意离子检验应排除杂质离子的干扰

练习册系列答案
相关题目
7.下列离子方程式表达正确的是( )
| A. | 用食醋除去水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| B. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 用稀氢氧化钠溶液吸收二氧化氮:2OH-+2NO2═NO3-+NO↑+H2O | |
| D. | 等物质的量的Ba(OH)2与(NH4)2Fe(SO4)2在溶液中反应:Ba2++2OH-+2NH4++SO42-═BaSO4↓+2NH3•H2O |
11.实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH $→_{170℃}^{H_{2}SO_{4}浓}$ CH2=CH2,CH2=CH2+Br2→BrCH2CH2Br.用少量的溴和足量的乙醇制备l,2-二溴乙烷的装置如图:

有关数据列表如下:
回答下列问题:
(1)在装置c中应加入③(选填序号),其目的是吸收反应中可能生成的酸性气体.
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)判断d管中制备二溴乙烷反应已结束的最简单方法是溴的颜色完全褪去.
(3)将二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的(填“上”或“下”)下层.
(4)若产物中有少量未反应的Br2,最好用②(填正确选项前的序号)洗涤除去.
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)反应过程中需用冷水冷却(装置e),其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但不用冰水进行过度冷却,原因是:1,2-二溴乙烷的凝固点较低,过度冷却会使其凝固而使气路堵塞
(6)以1,2-二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2-二溴乙烷通过( ①)反应制得( ②),②通过( ③)反应制得氯乙烯,由氯乙烯制得聚氯乙烯.
①消去反应(填反应类型) ② (填该物质的电子式)③加成反应(填反应类型)写出第一步的化学方程式
(填该物质的电子式)③加成反应(填反应类型)写出第一步的化学方程式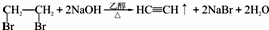 .
.

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在装置c中应加入③(选填序号),其目的是吸收反应中可能生成的酸性气体.
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)判断d管中制备二溴乙烷反应已结束的最简单方法是溴的颜色完全褪去.
(3)将二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的(填“上”或“下”)下层.
(4)若产物中有少量未反应的Br2,最好用②(填正确选项前的序号)洗涤除去.
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)反应过程中需用冷水冷却(装置e),其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但不用冰水进行过度冷却,原因是:1,2-二溴乙烷的凝固点较低,过度冷却会使其凝固而使气路堵塞
(6)以1,2-二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2-二溴乙烷通过( ①)反应制得( ②),②通过( ③)反应制得氯乙烯,由氯乙烯制得聚氯乙烯.
①消去反应(填反应类型) ②
 (填该物质的电子式)③加成反应(填反应类型)写出第一步的化学方程式
(填该物质的电子式)③加成反应(填反应类型)写出第一步的化学方程式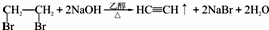 .
.  如图A是实验室制取某些气体的装置.
如图A是实验室制取某些气体的装置. 一定条件下,物质A~E转化关系如图,其中A为单质,常温下E为无色液体.
一定条件下,物质A~E转化关系如图,其中A为单质,常温下E为无色液体.

 HCO3-+OH-,与油污发生反应,达到去污目的.
HCO3-+OH-,与油污发生反应,达到去污目的.