题目内容
15.粉煤灰是燃煤电厂的废渣,主要成分为SiO2、Al2O3、Fe2O3和C等.实验室模拟工业从粉煤灰提取活性Al2O3,其流程如图: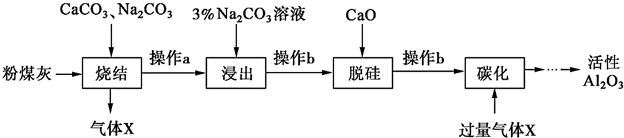
己知“烧结”过程的产物主要是:NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等
(1)写出“烧结“过程中铝元素转化的化学方碱Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑.
(2)操作a为冷却、研磨,其中研磨的目的是提高烧结产物浸出率.
(3)“浸出”过程中,NaFeO2可完全水解,水解反应的离子方程式为FeO2-+2H2O=Fe(OH)3↓+OH-.
(4)操作b的名称是过滤,所用的玻璃仪器有漏斗、玻璃棒和烧杯.
(5)“碳化”时生成沉淀,沉淀的化学式为Al(OH)3.
分析 粉煤灰是燃煤电厂的废渣,主要成分为SiO2、Al2O3、Fe2O3和C等,当加CaCO3、Na2CO3进行烧结,发生Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑、Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑、2CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Ca2SiO4+2CO2↑、Fe2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaFeO2+CO2↑、C+O2$\frac{\underline{\;高温\;}}{\;}$CO2,所以气体X为CO2,操作a为冷却、研磨,加入碳酸钠溶液浸出,AlO2-+2H2O?Al(OH)3+OH-,碳酸钠溶液呈碱性,抑制偏铝酸根离子的水解,NaFeO2可完全水解,FeO2-+2H2O=Fe(OH)3↓+OH-,操作b过滤出Fe(OH)3、Ca2SiO4,加入氧化钙脱硅,氧化钙和水反应生成氢氧化钙,氢氧化钙和硅酸根离子反应生成硅酸钙沉淀,操作b过滤出硅酸钙沉淀,滤液为NaAlO2,通入二氧化碳,碳酸酸性强于氢氧化铝,所以发生:NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓,过滤出沉淀氢氧化铝,加热氢氧化铝生成氧化铝和水,电解氧化铝得到铝和氧气,据此分析.
(1)“烧结“过程中氧化铝和碳酸钠反应生成偏铝酸钠和二氧化碳;
(2)研磨能提高烧结产物浸出率;
(3)“浸出”过程中,NaFeO2可完全水解,水解生成氢氧化铁沉淀;
(4)浸出液经过两次操作b分离沉淀,所以b为过滤,过滤用到的仪器有:玻璃棒、烧杯、铁架台、漏斗、滤纸等;
(5)碳酸酸性强于氢氧化铝,“碳化”时生成沉淀氢氧化铝.
解答 解:粉煤灰是燃煤电厂的废渣,主要成分为SiO2、Al2O3、Fe2O3和C等,当加CaCO3、Na2CO3进行烧结,发生Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑、Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑、2CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Ca2SiO4+2CO2↑、Fe2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaFeO2+CO2↑、C+O2$\frac{\underline{\;高温\;}}{\;}$CO2,所以气体X为CO2,操作a为冷却、研磨,加入碳酸钠溶液浸出,AlO2-+2H2O?Al(OH)3+OH-,碳酸钠溶液呈碱性,抑制偏铝酸根离子的水解,NaFeO2可完全水解,FeO2-+2H2O=Fe(OH)3↓+OH-,操作b过滤出Fe(OH)3、Ca2SiO4,加入氧化钙脱硅,氧化钙和水反应生成氢氧化钙,氢氧化钙和硅酸根离子反应生成硅酸钙沉淀,操作b过滤出硅酸钙沉淀,滤液为NaAlO2,通入二氧化碳,碳酸酸性强于氢氧化铝,所以发生:NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓,过滤出沉淀氢氧化铝,加热氢氧化铝生成氧化铝和水,电解氧化铝得到铝和氧气.
(1)“烧结“过程中氧化铝和碳酸钠反应:Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑,
故答案为:Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑;
(2)“烧结”过程的产物主要是:NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等,操作a的下一步为浸出,操作a为冷却、研磨,所以研磨的目的是提高烧结产物浸出率,
故答案为:提高烧结产物浸出率;
(3)碳酸钠溶液呈碱性,抑制偏铝酸根离子的水解,NaFeO2可完全水解,FeO2-+2H2O=Fe(OH)3↓+OH-,
故答案为:FeO2-+2H2O=Fe(OH)3↓+OH-;
(4)浸出液经过两次操作b分离沉淀,所以b为过滤,过滤时需要制作过滤器的漏斗、固定仪器的铁架台、引流用的玻璃棒、承接滤液的烧杯;所以还需用的玻璃仪器有漏斗、玻璃棒,
故答案为:过滤;漏斗、玻璃棒;
(5)操作b过滤出硅酸钙沉淀,滤液为NaAlO2,通入二氧化碳,碳酸酸性强于氢氧化铝,所以发生:NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓,所以“碳化”时生成沉淀氢氧化铝,
故答案为:Al(OH)3.
点评 本题考查了物质的分离、提纯的方法的应用,考查学生对工艺流程的理解、元素化合物性质等,明确各物质的性质是解本题的关键,侧重铁铝性质的考查,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | |
| 甲 | BaCl2 | Fe | Cu(NO3)2 |
| 乙 | Fe2O3 | K2SO4 | H2SO4 |
| 丙 | Zn | NaOH | MgCl2 |
(1)第Ⅲ组中有一种物质能与第Ⅰ组中的所有物质反应,这种物质是H2SO4.
(2)不跟第I组所有物质发生反应的,能跟第Ⅲ组中所有物质发生反应的是第II组物质中的NaOH,其化学反应方程式为2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3、2NaOH+H2SO4=Na2SO4+2H2O、2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
| A. | 该实验表明SO2有漂白性 | B. | 白色沉淀为BaSO4 | ||
| C. | 该实验表明FeCl3有氧化性 | D. | 反应后溶液酸性增强 |
| A. | BaCl2溶液 | B. | K2SO4溶液 | C. | CuSO4 | D. | NH4NO3溶液 |
| A. | 3:1:2:1 | B. | 1:3:2:2 | C. | 1:3:1:2 | D. | 3:1:2:2 |
| A. | 易形成-1价离子 | B. | 从上到下原子半径逐渐减小 | ||
| C. | 从上到下单质的氧化性逐渐减弱 | D. | 从上到下氢化物的稳定性依次减弱 |
| A. | 三聚氰胺的摩尔质量为126 | |
| B. | 用三聚氰胺制造的餐具不可以放进微波炉中加热使用 | |
| C. | 三聚氰胺中C、N两种元素的质量比为3:7 | |
| D. | 三聚氰胺中氮元素的质量分数约为66.7% |
| A. | Ca(OH)2 | B. |  | C. | NaAlO2 | D. | Na2SiO3 |