题目内容
20.下列说法中,不符合ⅦA族元素性质特征的是( )| A. | 易形成-1价离子 | B. | 从上到下原子半径逐渐减小 | ||
| C. | 从上到下单质的氧化性逐渐减弱 | D. | 从上到下氢化物的稳定性依次减弱 |
分析 A、ⅦA族元素最高正价为+7价,最低负价=最高正价-8;
B、ⅦA族元素从上到下电子层在增多,据此确定原子半径大小;
C、ⅦA族元素从上到下得电子的能力减弱,单质的氧化性逐渐减弱;
D、ⅦA族元素从上到下非金属性减弱,氢化物的稳定性逐渐减弱.
解答 解:A、因ⅦA族元素最高正价为+7价,则最低价为7-8=-1价,即易形成-1价离子,故A不选;
B、ⅦA族元素从上到下电子层数增多,则原子半径增大,故B选;
C、ⅦA族元素从上到下得电子的能力减弱,则非金属性逐渐减弱,故C不选;
D、ⅦA族元素从上到下非金属性减弱,则对应的氢化物的稳定性依次减弱,故D不选;
故选B.
点评 本题考查ⅦA族元素性质,熟悉原子结构及元素周期表、元素周期律即可解答,难度不大.

练习册系列答案
相关题目
10.下列说法正确的是( )
| A. | 电解质与非电解质的本质区别,是在水溶液中或熔融状态下能否电离 | |
| B. | 在水溶液中和熔融状态下都能导电的化合物叫电解质 | |
| C. | 酸、碱和盐类都属于电解质,其他化合物都是非电解质 | |
| D. | 常见的强酸、强碱和大部分盐都是电解质,其他化合物都是非电解质 |
11.在A?B+C反应中,温度每升高10℃,反应速率增大到原来的4倍,现将反应体系的温度由12℃升高到42℃,反应速率增加到原来的( )
| A. | 8倍 | B. | 12倍 | C. | 24倍 | D. | 64倍 |
5.关于CO2说法正确的是( )
| A. | 碳原子采取sp杂化 | B. | CO2晶胞是体心结构 | ||
| C. | 干冰是原子晶体 | D. | CO2为极性分子 |
12.研究性学习小组利用下列有关装置进行探究实验,回答相关问题.
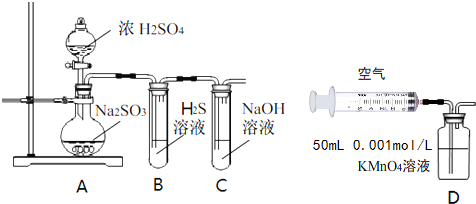
(1)写出A中的反应化学方程式Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O
(2)实验时,旋开装置A中分液漏斗的旋塞,发现液体流出缓慢,最终停止,其可能的原因是没有打开分液漏斗的上口活塞或分液漏斗上口活塞上的凹槽没有与分液漏斗上的小孔连通,导致无法与外界大气连通.
(3)装置B中的溶液出现浑浊,该实验证明SO2具有氧化性性.
(4)实验后,测定装置C中溶液呈碱性.溶液为什么呈碱性呢?大家有不同意见:①是生成的Na2SO3水解;②是氢氧化钠剩余.请设计实验方案证明哪种意见成立.选用下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
(5)另一小组利用装置D进行实验:用注射器向装置D共注入v mL实验室制备SO2的空气,当溶液刚好褪色,停止实验.该小组的实验目的是测定实验室空气中SO2含量.

(1)写出A中的反应化学方程式Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O
(2)实验时,旋开装置A中分液漏斗的旋塞,发现液体流出缓慢,最终停止,其可能的原因是没有打开分液漏斗的上口活塞或分液漏斗上口活塞上的凹槽没有与分液漏斗上的小孔连通,导致无法与外界大气连通.
(3)装置B中的溶液出现浑浊,该实验证明SO2具有氧化性性.
(4)实验后,测定装置C中溶液呈碱性.溶液为什么呈碱性呢?大家有不同意见:①是生成的Na2SO3水解;②是氢氧化钠剩余.请设计实验方案证明哪种意见成立.选用下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
| 实验步骤 | 实验操作 | 预期现象与结论 |
9.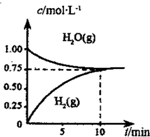 工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )
 工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )| A. | 达平衡时,CH4(g)的转化率为75% | |
| B. | 0~10min内,v(CO)=0.075mol•L-1•min-1 | |
| C. | 该反应的化学平衡常数K=O.1875 | |
| D. | 当CH4(g)的消耗速率与H2(g)的消耗速率相等时,反应到达平衡 |
10.盛满NO、NO2、O2混合气体的大试管倒置于盛水的水槽中,水面上升且充满试管,则NO、NO2、O2三种气体的体积比不可能是( )
| A. | 5:6:7 | B. | 1:1:1 | C. | 4:8:5 | D. | 8:4:7 |