题目内容
3.金属钠分别与下列溶液反应时,既有沉淀析出,又有气体逸出的是( )| A. | BaCl2溶液 | B. | K2SO4溶液 | C. | CuSO4 | D. | NH4NO3溶液 |
分析 金属钠遇水先发生反应,生成氢氧化钠并放出氢气:2Na+2H2O=2NaOH+H2↑,NaOH与CuSO4溶液反应会生成Cu(OH)2蓝色沉淀,与NH4NO3溶液反应会生成一水合氨和硝酸钠.
解答 解:A、金属钠先和BaCl2溶液中的水反应生成氢氧化钠并放出氢气:2Na+2H2O=2NaOH+H2↑,但是生成的氢氧化钠和氯化钡不反应,即只有气体生成,故A错误;
B、金属钠先和硫酸钾溶液中的水反应生成氢氧化钠并放出氢气:2Na+2H2O=2NaOH+H2↑,但是生成的氢氧化钠和硫酸钾不反应,只有气体生成,故B错误;
C、Na首先和水反应生成氢氧化钠并放出氢气:2Na+2H2O=2NaOH+H2↑,NaOH与CuSO4溶液反应会生成Cu(OH)2蓝色沉淀,既有沉淀析出,又有气体逸出,故C正确;
D、Na首先和水反应生成氢氧化钠并放出氢气:2Na+2H2O=2NaOH+H2↑,NaOH与NH4NO3溶液反应会生成一水合氨和硝酸钠,没有沉淀生成,只有气体生成,故D错误.
故选C.
点评 本题关键要知道Na首先和水反应生成氢氧化钠并放出氢气,主要看NaOH是否与选项中的溶液反应生成沉淀.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列物质中,既不与亚硫酸反应又不与SO2反应的是( )
| A. | H2S | B. | O2 | C. | NaOH | D. | S |
14.在化学反应中,会发生变化的是( )
| A. | 质子数 | B. | 中子数 | C. | 电子数 | D. | 质量数 |
11.在A?B+C反应中,温度每升高10℃,反应速率增大到原来的4倍,现将反应体系的温度由12℃升高到42℃,反应速率增加到原来的( )
| A. | 8倍 | B. | 12倍 | C. | 24倍 | D. | 64倍 |
18.在t℃下,某反应达到平衡,平衡常数K=c(NO)c(SO3)c(NO2)c(SO2).恒容时,温度升高,NO浓度减小.下列说法正确的是( )
| A. | 该反应的焓变为正值 | |
| B. | K表达式中,C(SO3)指反应在该条件下达到化学平衡时SO3的物质的量浓度 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应化学方程式为:NO+SO3?NO2+SO2 |
12.研究性学习小组利用下列有关装置进行探究实验,回答相关问题.
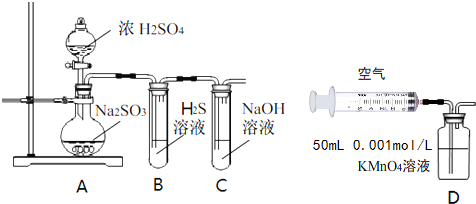
(1)写出A中的反应化学方程式Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O
(2)实验时,旋开装置A中分液漏斗的旋塞,发现液体流出缓慢,最终停止,其可能的原因是没有打开分液漏斗的上口活塞或分液漏斗上口活塞上的凹槽没有与分液漏斗上的小孔连通,导致无法与外界大气连通.
(3)装置B中的溶液出现浑浊,该实验证明SO2具有氧化性性.
(4)实验后,测定装置C中溶液呈碱性.溶液为什么呈碱性呢?大家有不同意见:①是生成的Na2SO3水解;②是氢氧化钠剩余.请设计实验方案证明哪种意见成立.选用下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
(5)另一小组利用装置D进行实验:用注射器向装置D共注入v mL实验室制备SO2的空气,当溶液刚好褪色,停止实验.该小组的实验目的是测定实验室空气中SO2含量.

(1)写出A中的反应化学方程式Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O
(2)实验时,旋开装置A中分液漏斗的旋塞,发现液体流出缓慢,最终停止,其可能的原因是没有打开分液漏斗的上口活塞或分液漏斗上口活塞上的凹槽没有与分液漏斗上的小孔连通,导致无法与外界大气连通.
(3)装置B中的溶液出现浑浊,该实验证明SO2具有氧化性性.
(4)实验后,测定装置C中溶液呈碱性.溶液为什么呈碱性呢?大家有不同意见:①是生成的Na2SO3水解;②是氢氧化钠剩余.请设计实验方案证明哪种意见成立.选用下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
| 实验步骤 | 实验操作 | 预期现象与结论 |
 A、B、C、D、E、F是原子序数依次增大的短周期元素,B是短周期中金属性最强的元素,C是地壳中含量最高的金属元素,D单质的晶体是良好的半导体材料,E的最外层电子数与内层电子数之比为3:5,A与E同族.
A、B、C、D、E、F是原子序数依次增大的短周期元素,B是短周期中金属性最强的元素,C是地壳中含量最高的金属元素,D单质的晶体是良好的半导体材料,E的最外层电子数与内层电子数之比为3:5,A与E同族.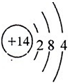
 .
. Al(OH)3﹢3H+,生氢氧化铝胶体,能吸附水中悬浮物,使之凝聚达到净水目的
Al(OH)3﹢3H+,生氢氧化铝胶体,能吸附水中悬浮物,使之凝聚达到净水目的