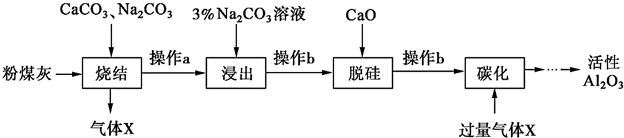
题目内容
5.如表有三组物质,每组均有甲、乙、丙三种物质(酸、碱、盐均为溶液).| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | |
| 甲 | BaCl2 | Fe | Cu(NO3)2 |
| 乙 | Fe2O3 | K2SO4 | H2SO4 |
| 丙 | Zn | NaOH | MgCl2 |
(1)第Ⅲ组中有一种物质能与第Ⅰ组中的所有物质反应,这种物质是H2SO4.
(2)不跟第I组所有物质发生反应的,能跟第Ⅲ组中所有物质发生反应的是第II组物质中的NaOH,其化学反应方程式为2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3、2NaOH+H2SO4=Na2SO4+2H2O、2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
分析 (1)硫酸与氯化钡反应生成硫酸钡沉淀和盐酸,硫酸与氧化铁反应生成硫酸铁和水,硫酸与锌反应生成硫酸锌和氢气,依此进行判断;
(2)氢氧化钠与氯化钡、氧化铁、锌都不反应;氢氧化钠与硝酸铜反应生成氢氧化铜沉淀和硝酸钠,氢氧化钠与硫酸反应生成硫酸钠和水,氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠,依此进行回答.
解答 解:(1)硫酸与氯化钡反应生成硫酸钡沉淀和盐酸,硫酸与氧化铁反应生成硫酸铁和水,硫酸与锌反应生成硫酸锌和氢气,故第Ⅲ组中的H2SO4能与第Ⅰ组中的所有物质反应,
故答案为:Ⅰ;H2SO4;
(2)氢氧化钠与氯化钡、氧化铁、锌都不反应;氢氧化钠与硝酸铜反应生成氢氧化铜沉淀和硝酸钠,方程式为:2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3,氢氧化钠与硫酸反应生成硫酸钠和水,方程式为:2NaOH+H2SO4=Na2SO4+2H2O,氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠,方程式为:2NaOH+MgCl2=Mg(OH)2↓+2NaCl,
故答案为:NaOH,2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3,2NaOH+H2SO4=Na2SO4+2H2O,2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
点评 本题考查基本化学反应,难度不大.了解常见物质的性质是解答本题的关键.

练习册系列答案
相关题目
16.(双选)关于氧化还原反应的下列说法中正确的是( )
| A. | 氧化还原反应前后元素化合价有升降 | |
| B. | 氧化还原反应前后一定有氧的得失 | |
| C. | 氧化还原反应前后一定有电子转移 | |
| D. | 复分解反应和化合反应一定是氧化还原反应 |
13.下列物质中,既不与亚硫酸反应又不与SO2反应的是( )
| A. | H2S | B. | O2 | C. | NaOH | D. | S |
20.有可能混有下列物质的13.2g (NH4)2SO4样品,将该样品在加热条件下与过量NaOH溶液反应,可收集4.3L(标况)气体,则该样品不可能含有的物质是( )
| A. | NH4HCO3和NH4NO3 | B. | (NH4)2CO3和NH4Cl | C. | NH4Cl和NH4HCO3 | D. | NH4Cl和NH4NO3 |
10.下列说法正确的是( )
| A. | 电解质与非电解质的本质区别,是在水溶液中或熔融状态下能否电离 | |
| B. | 在水溶液中和熔融状态下都能导电的化合物叫电解质 | |
| C. | 酸、碱和盐类都属于电解质,其他化合物都是非电解质 | |
| D. | 常见的强酸、强碱和大部分盐都是电解质,其他化合物都是非电解质 |
17.钠在自然界中主要的存在形式是( )
| A. | 单质 | B. | 氧化物 | C. | 氢氧化物 | D. | 盐 |
14.在化学反应中,会发生变化的是( )
| A. | 质子数 | B. | 中子数 | C. | 电子数 | D. | 质量数 |
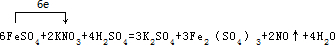 .
.