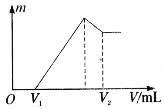
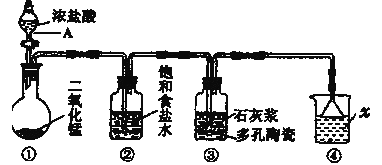
题目内容
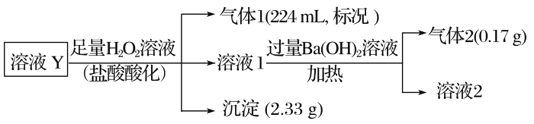
【题目】某无色溶液Y的可能含有Na+、Fe3+、Ba2+、NH4+、Cl-、SO42-、HCO3-、HSO3-中的几种离子,溶液中阳离子浓度相同。为了确定其组成,某同学进行了如下实验(假设气体均全部逸出,忽略H2O2的分解)下列说法不正确的是
A.溶液Y中一定不存在Fe3+、SO42-
B.溶液Y中一定含有Cl-,且n(Cl-)=001mol
C.沉淀中肯定只含有BaSO4
D.溶液Y中可能存在Na+,为确定是否存在,可取溶液1通过焰色反应实验验证
【答案】B
【解析】
由实验可知,加足量的H2O2,可氧化HSO3-为SO42-,酸化得到的气体1为二氧化碳,则一定含n(HCO3-)=![]() =0.01mol,沉淀2.33g为BaSO4,则原溶液中一定含Ba2+和HSO3-,n(BaSO4)=
=0.01mol,沉淀2.33g为BaSO4,则原溶液中一定含Ba2+和HSO3-,n(BaSO4)=![]() =0.01mol,Ba2+和HSO3-的物质的量至少为0.01mol。原溶液中含Ba2+,则一定不含SO42-。由溶液无色可知一定不含Fe3+;溶液1中加过量氢氧化钡、加热生成的气体2为氨气,则原溶液一定含n(NH4+)=
=0.01mol,Ba2+和HSO3-的物质的量至少为0.01mol。原溶液中含Ba2+,则一定不含SO42-。由溶液无色可知一定不含Fe3+;溶液1中加过量氢氧化钡、加热生成的气体2为氨气,则原溶液一定含n(NH4+)=![]() =0.01mol,没有沉淀生成说明没有SO42-,即在原溶液中HSO3-的物质的量为0.01mol,则Ba2+的物质的量至少为0.01mol。根据电荷守恒,原溶液中一定存在Cl-,其物质的量至少为0.01×2+0.01-0.01-0.01=0.01mol。由上述分析可知,原溶液中一定含Ba2+、NH4+、HCO3、HSO3、Cl-,物质的量分别为:至少0.01mol、0.01mol、0.01mol、0.01mol、至少0.01mol。一定不含Fe3+、SO42,不能确定原溶液中是否含Na+。
=0.01mol,没有沉淀生成说明没有SO42-,即在原溶液中HSO3-的物质的量为0.01mol,则Ba2+的物质的量至少为0.01mol。根据电荷守恒,原溶液中一定存在Cl-,其物质的量至少为0.01×2+0.01-0.01-0.01=0.01mol。由上述分析可知,原溶液中一定含Ba2+、NH4+、HCO3、HSO3、Cl-,物质的量分别为:至少0.01mol、0.01mol、0.01mol、0.01mol、至少0.01mol。一定不含Fe3+、SO42,不能确定原溶液中是否含Na+。
A. 根据以上分析,溶液Y 中一定不存在Fe3+、SO42-,故A正确;
B. 根据以上分析,溶液Y中一定含有Cl-,且n(Cl-)≥001mol,故B错误;
C. 根据上述分析,沉淀中肯定只含有BaSO4,故C正确;
D. Na+焰色反应呈黄色,溶液A中可能存在Na+,为了确定是否存在,可取溶液通过焰色反应验证,故D正确;
答案为B。

【题目】根据研究有机化合物的步骤和方法,填满下列空格:
实验步骤 | 解释或实验结论 |
(1)测得A的蒸气密度是同状况下甲烷的4.375倍,试通过计算填空: | (1)A的相对分子质量为_______。 |
(2)将此A 5.6g在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重7.2g和17.6g | (2)A的实验式是________________。 (3)A的分子式为 _______________。 |
(3)将A通入溴水中,溴水褪色 | (4)说明A属于______________类(若溴水不褪色,则A属于 __________类) |
(4)A的核磁共振氢谱如图: | (5)综上所述,A的结构简式为 ______________。 |