题目内容
【题目】KNO3固体样品中含有少量的KCl、BaCl2杂质,为了提纯KNO3并分离得到BaCl2,进行如下实验操作:
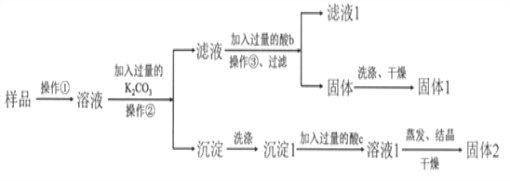
(1)试剂c的化学式是__________,固体1的化学式是__________。加入过量K2CO3所发生反应的化学方程式为________________________________。
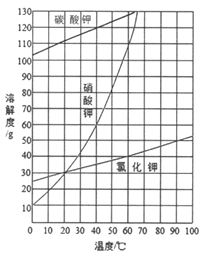
(2)结合下图各物质的溶解度曲线可知操作③的名称是_______、________。
(3)有同学认为操作③之前无需加入过量的酸b,也能得到纯净的固体1,你认为该同学的观点是否正确?_____;并做出相应解释___________________________。
【答案】HCl KNO3 BaCl2+K2CO3=BaCO3↓+2KCl 蒸发浓缩 冷却结晶 正确 由于硝酸钾的溶解度随温度降低急剧下降,因此有大量硝酸钾晶体析出,而碳酸钾溶解度很大,因而不会结晶析出
【解析】
样品溶解后加入过量K2CO3溶液,生成碳酸钡沉淀和氯化钾,过滤得到碳酸钡沉淀经过洗涤、再加过量的盐酸(c)发生反应得到氯化钡溶液,经蒸发、结晶、干燥可得到氯化钡固体;由于K2CO3过量,所以滤液中的物质有KNO3、KCl和K2CO3,因此要得到纯净的KNO3就需要除去K2CO3,所以加入过量的酸b为稀硝酸最合适,K2CO3和稀硝酸反应生成KNO3、水和二氧化碳,则所得溶液主要为KNO3和KCl,利用溶解度随温度变化不同,操作③可以采用蒸发浓缩、冷却结晶,析出KNO3晶体,过滤、洗涤、干燥得到固体1为KNO3;据此解答。
(1)本实验是为了提纯KNO3并分离得到BaCl2,固体1是硝酸钾,固体2就是氯化钡,所以试剂c是稀盐酸。加入过量K2CO3所发生反应的化学方程式为BaCl2+K2CO3=BaCO3↓+2KCl。
(2)根据图像可知KNO3的溶解度随温度降低急剧下降,KCl的溶解度随温度变化较小,因此将KNO3和KCl分离需要蒸发浓缩、冷却结晶,即操作③是蒸发浓缩、冷却结晶。
(3)该同学的观点正确。由于硝酸钾的溶解度随温度降低急剧下降,因此冷却结晶有大量硝酸钾晶体析出,而碳酸钾溶解度很大,因而不会结晶析出,所以操作③之前无需加入过量的盐酸除碳酸钾。

 口算能手系列答案
口算能手系列答案