题目内容
将能量进行一定的转化,是充分利用能源的一种方式,如可将生物质能转化为电能.
(1)原电池可将化学能转化为电能.若Fe、Cu和浓硝酸构成原电池,负极是 (填“Cu”或“Fe”);若Zn、Ag和稀盐酸构成原电池,正极发生 反应(填“氧化”或“还原”),电解质溶液中阳离子移向 极.
(2)电能也可以转化为化学能.用石墨做电极电解饱和食盐水时,阳极的电极反应式为 ;若电解1L 0.5mol/L的NaCl溶液,产生标准状况下的H2 2.24L时,转移电子的物质的量是 mol,溶液中NaOH的物质的量浓度是 mol/L(假设溶液的体积不变).
(1)原电池可将化学能转化为电能.若Fe、Cu和浓硝酸构成原电池,负极是
(2)电能也可以转化为化学能.用石墨做电极电解饱和食盐水时,阳极的电极反应式为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)原电池是将化学能转变为电能的装置,Fe、Cu和浓硝酸构成原电池,Fe与浓硝酸发生钝化,而Cu与浓的硝酸发生自发的氧化还原反应,Cu失去电子作负极,被氧化,正极上正5价的氮得到电子生成二氧化氮,若Zn、Ag和稀盐酸构成原电池,锌与盐酸发生自发的氧化还原反应,所以银作正极,原电池中阳离子向正极移动,以此来解答;
(2)阳极发生氧化反应,氯离子在阳极放电生成氯气,根据电解方程式计算阳极上产物的体积,根据氢气和氢氧根离子之间的关系式计算溶液中氢氧根离子浓度.
(2)阳极发生氧化反应,氯离子在阳极放电生成氯气,根据电解方程式计算阳极上产物的体积,根据氢气和氢氧根离子之间的关系式计算溶液中氢氧根离子浓度.
解答:
解:(1)原电池是将化学能转变为电能的装置,Fe、Cu和浓硝酸构成原电池,Fe与浓硝酸发生钝化,而Cu与浓的硝酸发生自发的氧化还原反应,Cu失去电子作负极,被氧化,正极上正5价的氮得到电子生成二氧化氮,若Zn、Ag和稀盐酸构成原电池,锌与盐酸发生自发的氧化还原反应,所以银作正极,原电池中阳离子向正极移动,
故答案为:Cu;还原;正;
(2)电解饱和食盐水时,阳极发生氧化反应阳极是氯离子失电子生成氯气的过程,电极反应式为2Cl--2e-=Cl2↑,1L 0.5mol/L的NaCl溶液,产生标准状况下的H2 2.24L时,转移电子的物质的量=
×2=0.2mol,消耗氯化钠0.2mol,生成氢氧化钠的物质的量为0.2mol,所以氢氧化钠的浓度为:
=0.2mol/L,
故答案为:2Cl--2e-=Cl2↑;0.2;0.2
故答案为:Cu;还原;正;
(2)电解饱和食盐水时,阳极发生氧化反应阳极是氯离子失电子生成氯气的过程,电极反应式为2Cl--2e-=Cl2↑,1L 0.5mol/L的NaCl溶液,产生标准状况下的H2 2.24L时,转移电子的物质的量=
| 2.24 |
| 22.4 |
| 0.2mol |
| 1L |
故答案为:2Cl--2e-=Cl2↑;0.2;0.2
点评:本题考查原电池,明确原电池中的能量转化及电极反应是解答本题的关键,电解池原理及有关计算,明确电极即注意离子的放电顺序是关键,注重基础知识的考查,题目较简单.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A、反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B、在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3给出孤对电子 |
| C、向反应后的溶液加入乙醇,溶液没有发生变化 |
| D、沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ |
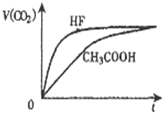 相同温度,浓度均为0.1mol/L,等体积的三种溶液:①HF溶液、②CH3COOH溶液、③NaHCO3溶液,已知将 ①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)的变化如图所示,下列说法正确的是( )
相同温度,浓度均为0.1mol/L,等体积的三种溶液:①HF溶液、②CH3COOH溶液、③NaHCO3溶液,已知将 ①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)的变化如图所示,下列说法正确的是( )| A、上述三种溶液中:c( OH-)大小:③>②>① |
| B、物质酸性的比较:CH3COOH>HF>H2CO3 |
| C、反应结束后所得两溶液中,c(CH3COO-)>c(F-) |
| D、①和 ③反应结束后所得溶液中:c(F-)+c(HF)═0.10mol/L |