题目内容
某高二化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果如下.试根据下表中的实验现象回答下列问题:
(1)写出实验3中的电极反应式和电池总反应方程式:
正极反应式: ;
负极反应式: ;
电池总反应方程式: .
(2)实验4中Al作 极,写出Al电极的电极反应式: .
(3)解释实验5中电流计指针偏向Al的原因: .
(4)根据实验结果总结:在原电池中金属铝作正极还是作负极受到哪些因素的影响: .
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | NaOH | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
正极反应式:
负极反应式:
电池总反应方程式:
(2)实验4中Al作
(3)解释实验5中电流计指针偏向Al的原因:
(4)根据实验结果总结:在原电池中金属铝作正极还是作负极受到哪些因素的影响:
考点:探究原电池及其工作原理
专题:电化学专题
分析:(1)实验3中Al为负极,石墨为正极,电池反应为2Al+6HCl═2AlCl3+3H2↑;
(2)实验4中发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,Al失去电子,则Al为负极;
(3)实验5中Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,所以电流计指针偏向铝;
(4)在原电池中,正负极的判断依据:失电子的极是负极,得电子的极是正极.
(2)实验4中发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,Al失去电子,则Al为负极;
(3)实验5中Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,所以电流计指针偏向铝;
(4)在原电池中,正负极的判断依据:失电子的极是负极,得电子的极是正极.
解答:
解:(1)实验3中Al为负极,电极反应为2Al-6e-═2Al3+,石墨为正极,其电极反应为6H++6e-═3H2↑,电池总反应为2Al+6HCl═2AlCl3+3H2↑,
故答案为:6H++6e-═3H2↑;2Al-6e-═2Al3+;2Al+6HCl═2AlCl3+3H2↑;
(2)实验4中Mg不与naOH溶液发生反应,而发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,Al失去电子,则Al为负极,负极反应为:Al-3e-+4OH-═AlO2-+2H2O,
故答案为:负;Al-3e-+4OH-═AlO2-+2H2O;
(3)实验5中Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝,
故答案为:Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝;
(4)在原电池中金属铝作正极还是作负极,一定要看自发的氧化还原反应中金属铝是否参与反应,金属铝参加反应,失电子,做负极,反之作正极,
故答案为:自发的氧化还原反应中金属铝是否参与反应,金属铝参加反应,失电子,做负极,反之作正极.
故答案为:6H++6e-═3H2↑;2Al-6e-═2Al3+;2Al+6HCl═2AlCl3+3H2↑;
(2)实验4中Mg不与naOH溶液发生反应,而发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,Al失去电子,则Al为负极,负极反应为:Al-3e-+4OH-═AlO2-+2H2O,
故答案为:负;Al-3e-+4OH-═AlO2-+2H2O;
(3)实验5中Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝,
故答案为:Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝;
(4)在原电池中金属铝作正极还是作负极,一定要看自发的氧化还原反应中金属铝是否参与反应,金属铝参加反应,失电子,做负极,反之作正极,
故答案为:自发的氧化还原反应中金属铝是否参与反应,金属铝参加反应,失电子,做负极,反之作正极.
点评:本题考查原电池原理,是一道关于原电池的综合实验题,考查角度广,明确发生的原电池反应及正负极的判断是解答本题的关键,题目难度诊断,注意利用氧化还原反应中电子的得失来分析原电池的正负极.

练习册系列答案
相关题目
在某无色透明溶液中,下列离子能大量共存的是( )
| A、Na+、Mg2+、Cl-、OH- |
| B、H+、Cu2+、NO3-、SO42- |
| C、Mg2+、SO42-、K+、NO3- |
| D、Na+、MnO4-、Ca2+、CO32- |
下列说法中,正确的是( )
| A、HCl和H2SO4属于同类化合物,但它们在水溶液里电离时生成有不同的阴离子,所以它们的化学性质有所不同 |
| B、无氧酸的正盐一定不含氢、氧元素 |
| C、能电离产生氢离子的化合物一定属于酸 |
| D、将Cu(OH)2加入到滴有石蕊试液的蒸馏水中,溶液呈蓝色 |
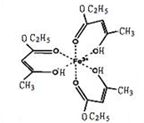 氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.
氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.