题目内容
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应N2(g)+3H2(g)═2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂 反应的△H(填“增大”、“减小”或“不改变”).
(2)已知:O2(g)═O2+(g)+e-△H1=+1175.7kJ?mol-1
PtF6(g)+e-═PtF6-(g)△H2=-771.1kJ?mol-1
O2PtF6(s)═O2+(g)+PtF6-(g)△H3=+482.2kJ?mol-1
则反应O2(g)+PtF6(g)═O2PtF6(s)的△H= kJ?mol-1.
(1)合成氨反应N2(g)+3H2(g)═2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
(2)已知:O2(g)═O2+(g)+e-△H1=+1175.7kJ?mol-1
PtF6(g)+e-═PtF6-(g)△H2=-771.1kJ?mol-1
O2PtF6(s)═O2+(g)+PtF6-(g)△H3=+482.2kJ?mol-1
则反应O2(g)+PtF6(g)═O2PtF6(s)的△H=
考点:化学平衡的影响因素,热化学方程式
专题:化学反应中的能量变化,化学平衡专题
分析:(1)恒压条件下向平衡体系中通入氩气,体积增大,平衡向逆方向移动;催化剂对反应热不影响;
(2)利用盖斯定律解答,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得.
(2)利用盖斯定律解答,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得.
解答:
解:(1)恒压条件下向平衡体系中通入氩气,体积增大,平衡向逆方向移动;加入催化剂,只改变反应的活化能,但反应热不变,故答案为:向左;不改变;
(2)已知:
①O2(g)=O2+(g)+e-△H1=+1175.7kJ?mol-1
②PtF6(g)+e-=PtF6-(g)△H2=-771.1kJ?mol-1
③O2PtF6(S)=O2+(g)+PtF6-(g)△H3=+482.2kJ?mol-1
据盖斯定律,①+②-③得:O2(g)+PtF6(g)=O2PtF6(s)△H=-77.6 kJ?mol-1,
故答案为:-77.6.
(2)已知:
①O2(g)=O2+(g)+e-△H1=+1175.7kJ?mol-1
②PtF6(g)+e-=PtF6-(g)△H2=-771.1kJ?mol-1
③O2PtF6(S)=O2+(g)+PtF6-(g)△H3=+482.2kJ?mol-1
据盖斯定律,①+②-③得:O2(g)+PtF6(g)=O2PtF6(s)△H=-77.6 kJ?mol-1,
故答案为:-77.6.
点评:本题考查化学平衡移动的问题,侧重于化学平衡移动的综合考查和盖斯定律的应用,题目难度中等,学生只要掌握解答该题的关键,做题时注意体会.

练习册系列答案
相关题目
在某无色透明溶液中,下列离子能大量共存的是( )
| A、Na+、Mg2+、Cl-、OH- |
| B、H+、Cu2+、NO3-、SO42- |
| C、Mg2+、SO42-、K+、NO3- |
| D、Na+、MnO4-、Ca2+、CO32- |
下列粒子(或化学键)的数目之比不是1:1的是( )
| A、氘原子中的质子和中子 |
| B、Na2O2固体中的阴离子和阳离子 |
| C、CO2分子中的σ键和π键 |
| D、常温下,pH=7的CH3COOH与CH3COONa混合溶液中的H+与OH- |
下列反应属于取代反应的是( )
| A、乙醇和浓硫酸混合加热至170℃ |
| B、苯和液溴混合后加入少量铁屑 |
| C、甲苯与酸性高锰酸钾溶液混合 |
| D、乙烯通入酸性高锰酸钾溶液中 |
有一类最简单的有机硅化物叫硅烷,它们的组成与烷烃相似.下列说法中错误的是( )
| A、硅烷的分子式可用通式SinH2n+2表示 |
| B、甲硅烷(SiH4)没有甲烷稳定 |
| C、甲硅烷易燃烧,生成SiO2和H2O |
| D、甲硅烷的密度比甲烷的密度小 |
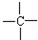 和
和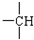 等结合成的.如果某烷分子中同时存在这4种基团,所含碳原子数最小,这种烷烃分子应含
等结合成的.如果某烷分子中同时存在这4种基团,所含碳原子数最小,这种烷烃分子应含