题目内容
相同温度、相同浓度的溶液,pH值最小的是
| A.NH4Cl | B.NH4HCO3 | C.NH4HSO4 | D.(NH4)2 SO4 |
C
解析试题分析:A. NH4Cl只存在NH4+的水解作用,水解使溶液显酸性,B.NH4HCO3电离产生的阳离子、阴离子都发生水解反应,由于HCO3-的水解程度略大屑,所以溶液显酸性,但是不如等浓度的NH4Cl酸性强;C.NH4HSO4是强酸的酸式盐,在溶液中发生电离:C.NH4HSO4= NH4++H++ SO42-。NH4+还有的水解作用,水解也使溶液显酸性,但是主要是电离作用,D.(NH4)2 SO4电离产生的NH4+浓度比NH4+大,增大反应物的浓度,水解平衡正向移动,所以水解作用产生的溶液的酸性比NH4+Cl强。由于盐的水解作用是微弱的,因此溶液的酸性最强的是NH4HSO4,选项是C。
考点:考查盐的水解、电离、溶液的酸性强弱的比较的知识。

工业上“固定”和利用CO2能有效地减轻“温室’效应。有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH =-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH =-49.0 kJ·mol-1
(1)在相同温度和容积不变时,能说明该反应已达平衡状态的是
| A.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1 |
| B.容器内压强保持不变 |
| C.H2的消耗速率与CH3OH的消耗速率之比为3∶1 |
| D.容器内的密度保持不变 |
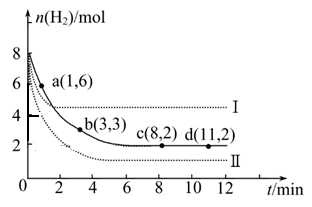
① a点正反应速率 逆反应速率(填“大于”、“等于”或“小于”)。
② 仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 。
③ 在题给图中绘出加入催化剂对应的曲线。
④ 结合图给实线的数据,计算该温度时反应的化学平衡常数。(写出计算过程)
(3)甲醇可用以制燃料电池,常用KOH作电解质溶液,负极的电极反应式为: 。
某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响。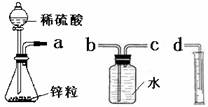
(1)为达到本实验目的其装置连接顺序为:a连________,________连________.
(2)连接好装置后的下一步操作是
(3)锥形瓶中发生反应的离子方程式为
(4)两套装置的分液漏斗所装的试剂分别为1mol/L硫酸和4mol/L硫酸,该小组同学要测定并记录的数据如下表:
| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1mol/L硫酸酸 | 10mL | t1 | v1 |
| 4mol/L硫酸 | 10mL | t2 | v2 |
(5)另有一组同学测定了每隔一分钟,锥形瓶中硫酸的浓度,记录结果如下:

请在给定的坐标图中作出v(H2)-t的图像.
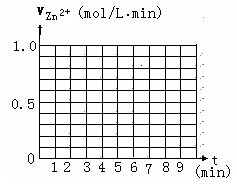
请解释0到4mim时该化学反应速率随时间变化的原因: .
(6)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方案有: (任写一种).
常温下,在0.1mol/L的碳酸钠溶液中,下列离子浓度的关系式正确的是
A.2c(H2CO3)+c(HCO )+c(H+) = c(OH-) )+c(H+) = c(OH-) |
B.c(Na+) = c(HCO )+c(H2CO3)+ 2c(CO )+c(H2CO3)+ 2c(CO ) ) |
C.c(Na+)>c(H+)>c(OH-)>c(CO ) ) |
D.c(Na+)+c(H+) = c(HCO )+c(OH-)+ 2c(CO )+c(OH-)+ 2c(CO ) ) |
对常温下0.1 mol/L的醋酸溶液,以下说法正确的是
| A.由水电离出来的的c(H+)=1.0×10-13 mol/L |
| B.c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) |
| C.与同浓度的盐酸分别加水稀释10倍后:pH(醋酸)>pH(盐酸) |
| D.与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COO-)="0.1" mol/L |
下列表述中,合理的是( )
| A.将水加热,Kw不变,pH不变 |
| B.把FeCl3的水溶液加热蒸干可得到FeCl3固体 |
| C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 |
| D.用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银 |
下列各离子浓度的大小比较,正确的是( )
| A.同浓度下列溶液中:① (NH4)2SO4 ② NH4HCO3 ③ NH4Cl④ NH3·H2O, c(NH4+)由大到小的顺序是:① > ③ > ② > ④ |
| B.常温时,将等体积的盐酸和氨水混合后,pH = 7,则c (NH4+) > c (Cl-) |
| C.0.2 mol·L-1 Na2CO3溶液中:c (OH-) =" c" (HCO3-) + c (H+) + c (H2CO3) |
| D.0.01 mol·L-1 的NH4Cl溶液与0.05mol·L-1 的NaOH溶液等体积混合: c (Cl-)> c (NH4+)> c (Na+)>c (OH-)>c (H+) |
下列有关说法正确的是( )
| A.常温下,0.1 mol·L—1Na2S溶液中存在:c(OH—)=c(H+) + c(HS—) + c(H2S) |
| B.常温下,0.1 mol·L—1HA溶液与0.1 mol·L—1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A—)>c(OH—)=c(H+) |
| C.常温下,向0.1 mol·L—1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时, 溶液中  的值增大到原来的10倍 的值增大到原来的10倍 |
| D.常温下,pH=7的CH3COONa和CH3COOH混合溶液中: |