题目内容
某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响。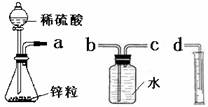
(1)为达到本实验目的其装置连接顺序为:a连________,________连________.
(2)连接好装置后的下一步操作是
(3)锥形瓶中发生反应的离子方程式为
(4)两套装置的分液漏斗所装的试剂分别为1mol/L硫酸和4mol/L硫酸,该小组同学要测定并记录的数据如下表:
| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1mol/L硫酸酸 | 10mL | t1 | v1 |
| 4mol/L硫酸 | 10mL | t2 | v2 |
(5)另有一组同学测定了每隔一分钟,锥形瓶中硫酸的浓度,记录结果如下:

请在给定的坐标图中作出v(H2)-t的图像.
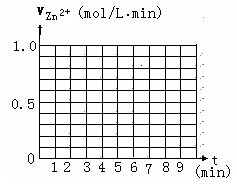
请解释0到4mim时该化学反应速率随时间变化的原因: .
(6)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方案有: (任写一种).
(1)cbd (2)检查装置的气密性 (3)Zn+2H+=Zn2++H2↑ (4)t1>t2
(5)该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快
(6)相同时间内测定生成H2的体积;相同时间内测定Zn的质量等。
解析试题分析:(1)将第一个装置制取的氢气收集到第二个装置中,并通过用量筒量取第二个装置排除水的体积来计算反应产生的氢气的体积。从而得到浓度与反应速率的关系。装置接口顺序是a—c---b---d. (2)因为有气体产生,而且要准确量取气体的体积。所以连接好装置后的下一步操作是检查装置的气密性.(3)锥形瓶中发生反应的离子方程式为Zn+2H+=Zn2++H2↑。(4)v1 小于v2,其定量依据是t1>t2。(5)v(H2)-t的图像略。0到4mim时该化学反应速率随时间变化的原因是该反应为放热反应,随反应的进行,溶液的温度不断升高,所以反应速率不断加快。(6)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方案有:相同时间内测定生成H2的体积;相同时间内测定Zn的质量等。
考点:考查仪器的连接、装置的气密性的检查及化学反应速率的测定方法等知识。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案硫元素的化合物在生产、生活中有着广泛的应用。
(1)400℃,1.01×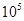 Pa下,容积为1.0L的密闭容器中充入0.5molSO2, (g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g)
Pa下,容积为1.0L的密闭容器中充入0.5molSO2, (g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g) 2SO3(g) △H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示
2SO3(g) △H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示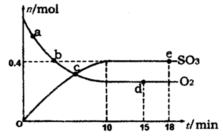 。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
| A.a点时刻的正反应速率比b点时刻的大 |
| B.c点时刻反应达到平衡状态 |
| C.d点和e点时刻的c(O2)相同 |
| D.若5 00℃,1.01×105Pa下,反应达到平衡时,n( SO3) 比图中e点时刻的值大 |
(3)可通过电解法使(2)中的吸收液再生而循环利用(电极均为石墨电极),其工作示意图如下:
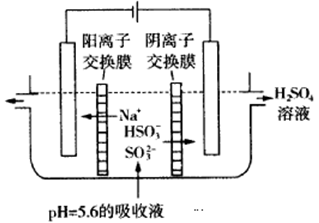
HSO3-在阳极室反应的电极反应式为________________________,阴极室的产物_________________。
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
CH3COOH+C2H5OH CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有:__________、__________等。
(2)若用如图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为________、________等。
(3)此反应以浓硫酸为催化剂,可能会造成__________、__________等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
| 同一反应时间 | | 同一反应温度 | ||||
| 反应温度/℃ | 转化率(%) | 选择性(%)* | | 反应时间/h | 转化率(%) | 选择性(%)* |
| 40 | 77.8 | 100 | | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | | 6 | 93.0 | 100 |
①根据表中数据,下列________(填字母)为该反应的最佳条件。
A.120 ℃,4 h B.80 ℃,2 h
C.60 ℃,4 h D.40 ℃,3 h
②当反应温度达到120 ℃时,反应选择性降低的原因可能为________。
(1)已知 甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为l0mL):
甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为l0mL):
其他条件不变时:探究温度对化学反应速率的影响,应选择实验_______(填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时问,可探究_____对化学反应速率的影响。
(2)某同学设计如下实验流程探究Na2S2O3的化学性质。
用离子方程式表示Na2S2O3溶液具有碱性的原因_______,实验操作①中测试时pH试纸的颜色应该接近 _______。
| A.红色 | B.深蓝色 | C.黄色 | D.绿色 |
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标况),实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大 min,原因是 ;
(2)哪一段时段的反应速率最小 min,原因是 ;
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:A.蒸馏水;BNa2SO4溶液;C.NaNO3溶液;D.CuSO4溶液;E.Na2CO3溶液,你认为可行的
是 (填写字母代号)。
为证明化学反应有一定的限度,进行如下探究活动:
I.取5mL 0.1mol/L的KI溶液,滴加5—6滴FeCl3稀溶液;
Ⅱ.继续加入2mL CCl4,盖好玻璃塞,振荡静置。
Ⅲ.取少量分液后得到的上层清液,滴加KSCN溶液。
Ⅳ.移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液用作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点。重复滴定三次,平均耗用c mol/LKI标准溶液VmL。
(1)探究活动I中发生反应的离子方程式为 。
请将探究活动Ⅱ中“振荡静置”后得到下层液体的操作补充完整:将分液漏斗放在铁架台上,静置。
。
(2)探究活动Ⅲ的意图是通过生成红色的溶液(假设溶质全部为Fe(SCN)3),验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+ 猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察。
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,密度为0.71g/mL,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4—反应生成暗蓝色沉淀,用K4[Fe(CN)6](亚铁氰化钾)溶液检验Fe3+的灵敏度比用KSCN溶液更高。
结合新信息,现设计以下实验方案验证猜想:
①请完成下表
| 实验操作 | 现象和结论 |
| 步骤一: | 若产生暗蓝色沉淀,则 。 |
| 步骤二: | 若乙醚层呈红色,则 。 |
②写出实验操作“步骤一”中的反应离子方程式: 。
(3)根据探究活动Ⅳ,FeCl3稀溶液物质的量浓度为 mol/L。
已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
反应速率最大的(填0~1、1~2、2~3、3~4、4~5min)时间段为 。原因是 。
②反应速率最小的时间段为 ,原因是
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率。
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他的做法可行的是 (填相应字母);做法不可行的是 (填相应字母),做法不可行的理由是 。
相同温度、相同浓度的溶液,pH值最小的是
| A.NH4Cl | B.NH4HCO3 | C.NH4HSO4 | D.(NH4)2 SO4 |
对于常温下pH=2的盐酸和pH=3的醋酸,下列说法正确的是
| A.pH=2的盐酸中:c(H+)=c(Cl-) + c(OH-) |
| B.pH=3的醋酸中:c(H+)=3.0 mol·L-1 |
| C.pH=2的盐酸与pH=3的醋酸中溶质的物质的量浓度之比为10:1 |
| D.pH=3的醋酸与pH=11的NaOH溶液等体积混合所得溶液中:c(Na+)=c(CH3COO-) |