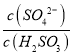题目内容
【题目】Cl2是一种重要的化工原料, 氯气极其相关产品在生产生活中应用广泛。结合氯气的相关知识解决下列问题;
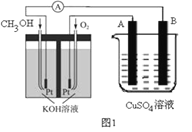
(1)由于氯气贮存运输不方便,工业上常将氯气转化为漂白粉,工业上生产漂白粉的主要化学方程式是______________________;漂白粉的有效成分是(填化学式)_________。漂白粉在空气中长期存放会变质而失效的原理是(用化学方程式说明) _____________。
(2)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 由于氯气有毒所以实验室通常用___________________溶液吸收尾气(填化学式),反应的化学方程式为_____________________。
MnCl2+Cl2↑+2H2O 由于氯气有毒所以实验室通常用___________________溶液吸收尾气(填化学式),反应的化学方程式为_____________________。
(3)氯气是一种常用的消毒剂,新制氯水含多种微粒并表现出不同的性质(用化学式或离子符号填写):
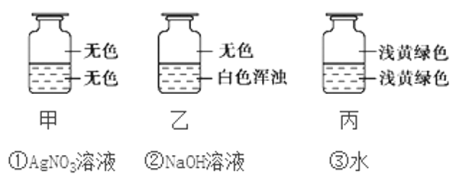
使氯水呈黄绿色的是________;能使AgNO3溶液产生白色沉淀的是________;能使紫色石蕊试液显红色的是________;能使红纸褪色的是________。
【答案】2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Ca(ClO)2 Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO、2HClO![]() 2HCl+O2↑ NaOH Cl2+2NaOH=NaCl+NaClO+H2O Cl2 Cl- H+ HClO
2HCl+O2↑ NaOH Cl2+2NaOH=NaCl+NaClO+H2O Cl2 Cl- H+ HClO
【解析】
(1)由于氯气贮存运输不方便,工业上常将氯气转化为漂白粉,工业上生产漂白粉利用的是氯气与氢氧化钙反应,反应的化学方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;漂白粉的有效成分是次氯酸钙,化学式为Ca(ClO)2。漂白粉在空气中长期存放会变质是因为次氯酸钙吸收空气中的水和二氧化碳生成次氯酸,次氯酸不稳定分解而失效,反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO、2HClO![]() 2HCl+O2↑。
2HCl+O2↑。
(2由于氯气有毒,所以实验室通常用NaOH溶液吸收尾气,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
(3)氯气是一种常用的消毒剂,新制氯水含多种微粒并表现出不同的性质。由于氯气是黄绿色气体,则使氯水呈黄绿色的是Cl2;氯离子能与银离子结合生成氯化银白色沉淀,能使AgNO3溶液产生白色沉淀的是Cl-;酸能使紫色的石蕊试液显红色,则能使紫色石蕊试液显红色的是H+;次氯酸具有漂白性,则能使红纸褪色的是HClO。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
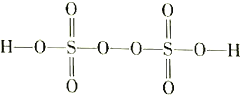
小学生10分钟应用题系列答案【题目】I.(1)键线式![]() 表示的有机物名称为__________。
表示的有机物名称为__________。
(2)A和B两种有机物可以互溶,其有关性质如表所示:
密度(20℃) | 熔点(℃) | 沸点(℃) | 溶解性 | |
A | 0.7137 g/mL | -116.6 | 34.5 | 不溶于水 |
B | 0.7893 g/mL | -117.3 | 78.5 | 与水以任意比混溶 |
要除去B中混有的少量A,可采用_________方法。
A.蒸馏 B.过滤 C.萃取 D.加水充分振荡,分液
Ⅱ.(1)扁桃酸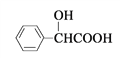 有多种同分异构体,属于甲酸酯且含酚羟基的同分异构体共有_______种。
有多种同分异构体,属于甲酸酯且含酚羟基的同分异构体共有_______种。
(2)分子式为C9H12 且属于苯的同系物的同分异构体的数目为_______
III.有下列各组物质:
(A)S2和S4
(B) ![]() 和
和![]()
(C)CH4和C8H18
(D) 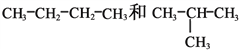
(E)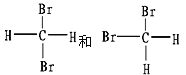
①_________组两物质互为同素异形体;
②_________组两物质互为同系物
IV.配平下列化学方程式,只需将配平后草酸的系数、二氧化氯的系数填入答题页上。
KClO3+______H2C2O4+H2SO4![]() _____ClO2↑+K2SO4+CO2↑+H2O
_____ClO2↑+K2SO4+CO2↑+H2O