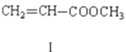题目内容
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
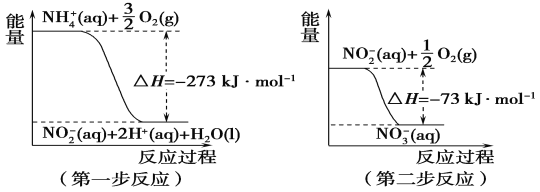
①第一步反应是________(填“放热”或“吸热”)反应。
②1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式:__________________。
(2)在298 K、101 kPa时,已知:2H2O(g)=O2(g)+2H2(g) ΔH1;
Cl2(g)+H2(g)=2HCl(g) ΔH2;
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3。
则ΔH3与ΔH1和ΔH2之间的关系正确的是___________。
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
(3)已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;ΔH1和ΔH2的关系是ΔH1_________ΔH2(填“>”、“<”或“=”)。
(4)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ/mol,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=________。
【答案】放热 NH4+(aq)+2O2(g)=2H+(aq)+H2O(l)+NO3-(aq)ΔH=-346 kJ/mol A < 369
【解析】
(1)根据反应物、生成物的能量 判断反应是放热反应还是吸热反应;
由图可知,第一步热化学反应为NH4+(aq)+1.5O2(g)=2H+(aq)+NO2-(aq)+H2O(l)△H=-273kJ/mol①,第二步热化学反应为NO2-(aq)+0.5O2(g)=NO3-(aq)△H=-73kJ/mol②,由盖斯定律书写1mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式。
(2)根据盖斯定律,将③-2×②=①,据此分析反应热的关系。
(3)由①P4(白磷,s)+5O2(g)=2P2O5(s) △H1;②4P(红磷,s)+5O2(g)=2P2O5(s) △H2;结合盖斯定律可知,②-①得到4P(红磷,s)=P4(白磷,s),结合红磷比白磷稳定来解答;
(4)焓根据反应热△H=反应物中键能之和-生成物中键能之和,据此分析解答。
(1)由图可知,第一步反应的反应物的能量比生成物的能量高,所以反应发生时放出热量,即第一步反应为放热反应;
第一步热化学反应为NH4+(aq)+1.5O2(g)=2H+(aq)+NO2-(aq)+H2O(l)△H=-273kJ/mol①,第二步热化学反应为NO2-(aq)+0.5O2(g)=NO3-(aq)△H=-73kJ/mol②,由盖斯定律可知①+②得1mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式为NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l) △H=-346kJ/mol;
(2)根据盖斯定律,将③-2×②可得①,故反应热△H3=△H1+2△H2,故选项A正确;
(3)由①P4(白磷,s)+5O2(g)=2P2O5(s) △H1;②4P(红磷,s)+5O2(g)=2P2O5(s) △H2;结合盖斯定律可知,②-①得到4P(红磷,s)=P4(白磷,s),由于红磷比白磷稳定,物质的能量越低,物质的稳定性就越强,说明红磷能量比白磷低,红磷转化为白磷为吸热反应,△H>0,即△H2-△H1>0,可知△H1<△H2;
(4)蒸发1mol Br2(l)需要吸收的能量为30kJ,结合反应及表格中数据可知,436+(200+30)-2×a=-72,解得a=369。

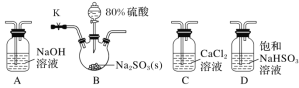
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
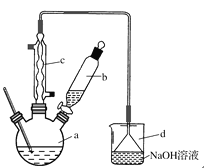
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。由b向a中加入4 mL液溴。烧瓶a中发生反应的化学方程式是______。装置d的作用是_________________;装置c的作用是__________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是________________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是____________。
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质的名称是________,进一步提纯操作方法是________。
(4)在该实验中,a的容积最适合的是________(填字母)。
A.25 mL B.50 mL C.250 mL D.500 mL
【题目】减少二氧化碳的排放,氮氧化物、二氧化硫的处理与利用是一项重要的热点课题.
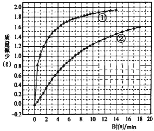
Ⅰ![]() 经催化加氢可合成低碳烯烃:
经催化加氢可合成低碳烯烃:![]() 在
在![]() 时,按
时,按![]() :
:![]() :3投料,图1所示不同温度
:3投料,图1所示不同温度![]() 下,平衡时的四种气态物质的物质的量
下,平衡时的四种气态物质的物质的量![]() 的关系.
的关系.
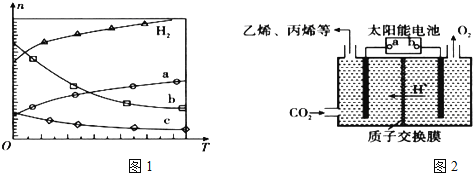
![]() 该反应的
该反应的![]() ______
______ ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() .
.
![]() 曲线b表示的物质为 ______ .
曲线b表示的物质为 ______ .
![]() 为提高
为提高![]() 的平衡转化率,除改变温度外,还可采取的措施是 ______ .
的平衡转化率,除改变温度外,还可采取的措施是 ______ .
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解![]() 可得到多种燃料,其原理如图2所示.
可得到多种燃料,其原理如图2所示.
b为电源的 ______ 极,电解时,生成乙烯的电极反应式是 ______ .
Ⅱ![]() (3)用活性炭还原法可以处理氮氧化物.如反应:
(3)用活性炭还原法可以处理氮氧化物.如反应:![]()
![]() . 在
. 在![]() 时,反应进行到不同时间测得各物质的浓度如下:
时,反应进行到不同时间测得各物质的浓度如下:
时间 浓度 | 0 | 10 | 20 | 30 | 40 | 50 |
NO |
|
|
|
|
|
|
| 0 |
|
|
|
|
|
| 0 |
|
|
|
|
|
![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() ______ .
______ .
![]() 后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 ______
后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 ______ ![]() 答一种即可
答一种即可![]() .
.
Ⅲ.(4)工业上可以用NaOH溶液或氨水吸收过量的![]() ,分别生成
,分别生成![]() 、
、![]() ,其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中
,其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中![]() 较小的是 ______ ,用文字和化学用语解释原因 ______ .
较小的是 ______ ,用文字和化学用语解释原因 ______ .
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
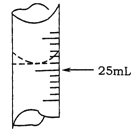
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(3)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 1.00 | 27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
(4)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数