��Ŀ����
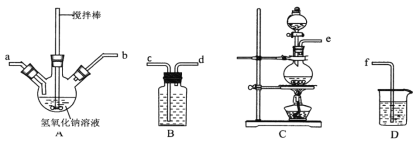
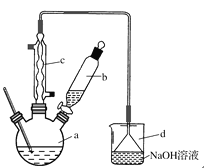
����Ŀ���屽��һ�ֻ���ԭ�ϣ�ʵ���Һϳ��屽��װ��ʾ��ͼ���й��������£�
�� | �� | �屽 | |
�ܶ�/g��cm��3 | 0.88 | 3.10 | 1.50 |
�е�/�� | 80 | 59 | 156 |
ˮ���ܽ�� | �� | �� | �� |
�����кϳɲ���ش����⣺
(1)��a�м���15 mL��ˮ����������м����b��a�м���4 mLҺ�塣��ƿa�з�����Ӧ�Ļ�ѧ����ʽ��______��װ��d��������_________________��װ��c��������__________________��
(2)Һ�����������в�������ᴿ��
����a�м���10 mLˮ��Ȼ����˳�ȥδ��Ӧ����м��
����Һ������10 mLˮ��8 mL 10%��NaOH��Һ��10 mLˮϴ�ӡ�NaOH��Һϴ�ӵ�������________________________��
����ֳ��Ĵ��屽�м�����������ˮ�Ȼ��ƣ����á����ˡ������Ȼ��Ƶ�Ŀ����____________��
(3)������������������屽�л����е���Ҫ���ʵ�������________����һ���ᴿ����������________��
(4)�ڸ�ʵ���У�a���ݻ����ʺϵ���________(����ĸ)��
A��25 mL B��50 mL C��250 mL D��500 mL
���𰸡�![]() +Br2
+Br2![]() +HBr ����HBr��Br2 ���������ͻ��� ��ȥHBr��δ��Ӧ��Br2 ���� �� ���� B
+HBr ����HBr��Br2 ���������ͻ��� ��ȥHBr��δ��Ӧ��Br2 ���� �� ���� B
��������
���������ñ���Һ�������廯���������������£���������ƿ�ڷ���ȡ����Ӧ�Ʊ��屽���漰�˷�Ӧԭ���Ŀ��飬��Ӧ������Ϊ��ֹҺ��ͱ��Ļӷ������ԭ�������ʣ��������ܽ�������������ͬʱ�������ɵ�HBr���壬����Ⱦ����Ӧ��Ļ����ͨ�����˳�ȥ��������ۣ�Ȼ��������������Һϴȥû�з�Ӧ���弰���ɵ�HBr��Ȼ��ͨ����Һ��������з����ᴿ����2���屽�к����壬��NaOH��Һ����δ��Ӧ��Br2���NaBr��NaBrOϴ��ˮ�У�Ȼ��Ӹ�������ݴ˽��
(1) ��������ƿ���DZ���Һ���������廯���������������£�������Ӧ�����屽���廯�⡣��Ӧ�Ļ�ѧ����ʽ��![]() +
+![]()
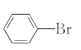 +HBr,��Ϊ��Ӧ����HBr�ͻӷ����������Ի����������Ⱦ������װ��d������������HBr��Br2��װ��c�������ܣ�������������Һ�壬����װ��c�������ǵ��������ͻ������𰸣�
+HBr,��Ϊ��Ӧ����HBr�ͻӷ����������Ի����������Ⱦ������װ��d������������HBr��Br2��װ��c�������ܣ�������������Һ�壬����װ��c�������ǵ��������ͻ������𰸣�![]() +
+![]()
 +HBr������HBr��Br2 �����������ͻ�����
+HBr������HBr��Br2 �����������ͻ�����
(2)�屽�ᴿ�ķ����ǣ���ˮϴ,�ѿ������ܽ���ˮ��,Ȼ����˳�ȥδ��Ӧ����м,�ټ�NaOH��Һ,��δ��Ӧ��Br2���NaBr��NaBrOϴ��ˮ�С�Ȼ��Ӹ������ˮ�Ȼ�������ˮ��,�����屽,�ʴ�Ϊ��ȥHBr��δ��Ӧ��Br2�����
(3) ��Ϊ���������屽�����Է�Ӧ��õ����屽������δ��Ӧ�ı������÷е㲻ͬ��������ķ������з��룻��Ϊ���ķе�С������������屽�е�߱�����ĸҺ�У����Բ�ȡ����ķ��������屽�뱽���ʴ�Ϊ��������
(4)��a�м���15 mL��ˮ����������м����b��a�м���4 mLҺ�塣Һ������Ϊ19mL������ƿ����Һ�壬�������������ƿ�����1/3,���ܴ����������2/3���ڸ�ʵ���У�a���ݻ����ʺϵ���50 mL���𰸣�B��

����Ŀ������������ζ����֮�ơ�������ʯ����Ҫ����SrSO4������CaCO3��MgO���ʣ������������ȵĹ������£�

��֪����������ˮ�е��ܽ�ȣ�
�¶ȣ��棩 | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
�ܽ�ȣ�g/100mL�� | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
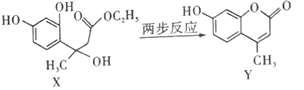
��1��������������ʱSrSO4ֻ����ԭ��SrS����ѧ����ʽΪ____��
��2��������������������Һ������95������NaOH��Һ����pHΪ12��
��95��ʱˮ�����ӻ�KW��1.0��10��12��Ksp[Mg(OH)2]��1.2��10��10������Һ��c��Mg2������____��
����pH���������������ȵIJ��ʽ��ͣ������ԭ��____��
��3�������ȹ�������Ŀ����____��������������Ҫ�ɷ�Ϊ___��
��4���ӳ��ȹ��˺����Һ�еõ�Sr(OH)2��Ʒ�IJ���Ϊ____�����ˡ�ϴ�ӡ����
��5������������������FeCl3��Һ����������������壬����ʱ����������Ϊ___���ѧʽ��������ʯī�缫�������Һ�������������������ѭ�����õ�������__��
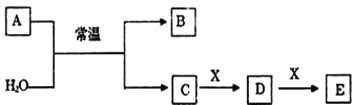
����Ŀ����������������п�̸ɵ�صĻ������ϣ���ҵ�������̿����̿�Ϊԭ�����Ʊ���ij���̿���Ҫ�ɷ�ΪMnO2��������Si(16.27%)��Fe(5.86%)��Al(3.42%)��Zn(2.68%)��Cu(0.86%)��Ԫ�ص�������䴦������ͼ���£�
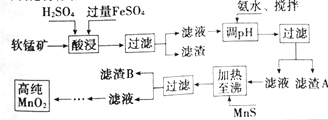
������ | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
KSP����ֵ | 10��34 | 10��16 | 10��38 |
��1���������̿���Ʒʱ��ͭ����ɫΪ___(����ĸ)��
A.��ɫ B.��ɫ C.��ɫ D.��ɫ
��2���������������������½�MnO2��ԭΪMnSO4�����ʱ��������Ҫ���ӷ�Ӧ����ʽΪ___��
��3������ˮ�����衱�����С����衱�����ܼӿ췴Ӧ���ʣ�����___������S�ijɷ���Fe(OH)3��Al(OH)3�����백ˮ�����pH���ٴﵽ___��ǡ����ʹFe3����Al3��������ȫ(��c��10��5mol��L��1ʱ����Ϊ�����ӳ�����ȫ)��
��4������B�ijɷ���___��
��5����ҵ�ϲ��ü��������ԭ�ζ����ⶨMnO2���ȣ�������������£�ȷ����0.9200g����Ʒ������������KI��Һ��ַ�Ӧ�����Ƴ�100mL��Һ��ȡ����10.00mL��ǡ����25.00mL0.0800 mol��L��1 Na2S2O3��Һ��Ӧ(I2��2S2O32����2I����S4O62��)���������Ʒ����Ϊ___%(��ȷ��0.1%)��
��6���ӷϾɼ���п�̵���п��Ի������õ�������___(д����)��
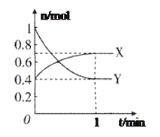
����Ŀ��(1)���������õ������£�NH4+����������Ӧ��������NO3-��������Ӧ�������仯ʾ��ͼ���£�
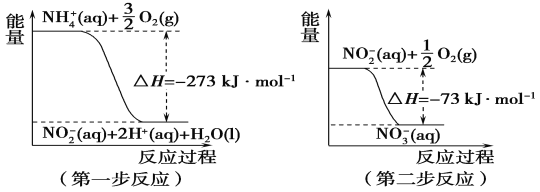
�ٵ�һ����Ӧ��________(��������������������)��Ӧ��
��1 mol NH4+(aq)ȫ��������NO3-(aq)���Ȼ�ѧ����ʽ��__________________��
(2)��298 K��101 kPaʱ����֪��2H2O(g)=O2(g)+2H2(g)����H1��
Cl2(g)+H2(g)=2HCl(g)�� ��H2��
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)����H3��
����H3����H1����H2֮��Ĺ�ϵ��ȷ����___________��
A.��H3=��H1+2��H2 B.��H3=��H1+��H2
C.��H3=��H1-2��H2 D.��H3=��H1-��H2
(3)��֪���ױȰ����ȶ�����ӦP4(���ף�s)+5O2(g)=2P2O5(s)����H1��P(���ף�s)��5O2(g)=2P2O5(s)����H2����H1����H2�Ĺ�ϵ����H1_________��H2(����>������<������=��)��
(4)��֪H2(g)��Br2(l)=2HBr(g)����H=-72 kJ/mol������1 mol Br2(l)��Ҫ���յ�����Ϊ30 kJ����������������±���
���� | H2(g) | Br2(g) | HBr(g) |
1 mol�����еĻ�ѧ������ʱ��Ҫ���յ�����(kJ) | 436 | 200 | a |
�����a=________��