题目内容
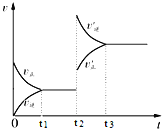
【题目】某化学小组为探究固体颗粒的大小对反应速率的影响,设计了下列实验:称取5.00g均匀的块状大理石![]() 含有
含有![]() 等不与盐酸反应的杂质
等不与盐酸反应的杂质![]() 与50.0mL 2.00mol/L稀盐酸混合,测得实验过程中逸出气体的质量并记录
与50.0mL 2.00mol/L稀盐酸混合,测得实验过程中逸出气体的质量并记录![]() 假设只逸出
假设只逸出![]() ;再称量5.00g大理石粉末,重复以上实验操作。实验数据汇总如图:
;再称量5.00g大理石粉末,重复以上实验操作。实验数据汇总如图:
下列说法正确的是
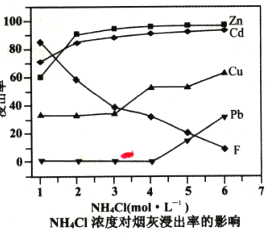
A.图中曲线![]() 表示的是块状大理石与盐酸反应
表示的是块状大理石与盐酸反应
B.由图可知,如果等待的时间足够长,两条曲线应逐渐交汇
C.大理石粉末与盐酸的实验中,0-8min内,盐酸的平均反应速率v(HCl)=1.64mol·L-1·min-1
D.块状大理石与盐酸的实验中,13min时,![]() 的消耗率为
的消耗率为![]()
【答案】B
【解析】
A.块状大理石和盐酸之间反应的速率不如大理石粉末和盐酸之间的反应快,图中曲线![]() 表示的是粉末状大理石与盐酸反应,选项A错误;
表示的是粉末状大理石与盐酸反应,选项A错误;
B.称取![]() 大理石
大理石![]() 含有SiO2等不与盐酸反应的杂质
含有SiO2等不与盐酸反应的杂质![]() 与
与![]() 稀盐酸混合,恰好完全反应,产生的气体量是一个定值,如果等待的时间足够长,两条曲线应逐渐交汇,选项B正确;
稀盐酸混合,恰好完全反应,产生的气体量是一个定值,如果等待的时间足够长,两条曲线应逐渐交汇,选项B正确;
C.大理石粉末与盐酸的实验中,![]() 内生成
内生成![]() CO2,根据反应方程式CaCO3+2HCl=CaCl2+H2O+CO2↑,消耗的HCl物质的量为
CO2,根据反应方程式CaCO3+2HCl=CaCl2+H2O+CO2↑,消耗的HCl物质的量为![]() ×2=0.0818mol,盐酸的平均反应速率υ(HCl)=
×2=0.0818mol,盐酸的平均反应速率υ(HCl)=![]() ÷8min=0.2045mol/(L·min),选项C错误;
÷8min=0.2045mol/(L·min),选项C错误;
D.块状大理石与盐酸的实验中,13min时,生成1.4gCO2,则消耗CaCO3的质量为![]() ×100g/mol=3.18g,由于大理石中含杂质,不能计算CaCO3的消耗率,选项D错误。
×100g/mol=3.18g,由于大理石中含杂质,不能计算CaCO3的消耗率,选项D错误。
答案选B。

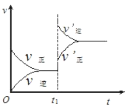
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:

①第一步反应是________(填“放热”或“吸热”)反应。
②1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式:__________________。
(2)在298 K、101 kPa时,已知:2H2O(g)=O2(g)+2H2(g) ΔH1;
Cl2(g)+H2(g)=2HCl(g) ΔH2;
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3。
则ΔH3与ΔH1和ΔH2之间的关系正确的是___________。
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
(3)已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;ΔH1和ΔH2的关系是ΔH1_________ΔH2(填“>”、“<”或“=”)。
(4)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ/mol,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=________。
【题目】某学习小组通过下列装置探究![]() 与
与![]() 能否反应产生
能否反应产生![]() 。
。
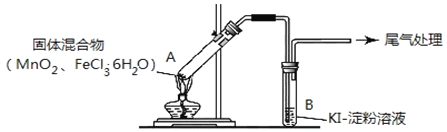
实验操作和现象如下表:
实验编号 | 操作 | 现象 |
实验1 | 按如图所示加热 |
|
实验2 | 把A中的混合物换为 B中溶液换为KSCN溶液,加热。 | A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红 |
回答下列问题:
![]() 实验1和实验2产生白雾的原因是__________________________________________。
实验1和实验2产生白雾的原因是__________________________________________。
![]() 实验2说明黄色气体中含有___________
实验2说明黄色气体中含有___________![]() 填化学式
填化学式![]() 则实验1中
则实验1中![]() 的现象也可能是发生了另一个离子反应,则其离子方程式为_________________________________________。
的现象也可能是发生了另一个离子反应,则其离子方程式为_________________________________________。
![]() 为进一步确认黄色气体中含有
为进一步确认黄色气体中含有![]() ,该学习小组对实验1提出两种改进方案:
,该学习小组对实验1提出两种改进方案:
方案1:在A、B间增加盛有某种试剂的洗气瓶C,结果B中溶液仍变为蓝色。
方案2:将B中淀粉KI溶液替换为NaBr溶液,结果B中溶液呈橙红色,且未检出![]() 。
。
则方案1中C中盛放的试剂是______;方案2中检验![]() 的试剂名称是______,选择NaBr溶液的依据是______________________________________________________。
的试剂名称是______,选择NaBr溶液的依据是______________________________________________________。
![]() 实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为_________________________________________,用离子方程式表示尾气处理的方式___________________________________。
实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为_________________________________________,用离子方程式表示尾气处理的方式___________________________________。
![]() 该学习小组认为实验1中溶液变蓝,可能还有另外一种原因是____________________。请你设计实验方案验证此猜想___________________________________________________________________________________________________________________________________________________。
该学习小组认为实验1中溶液变蓝,可能还有另外一种原因是____________________。请你设计实验方案验证此猜想___________________________________________________________________________________________________________________________________________________。