题目内容
【题目】减少二氧化碳的排放,氮氧化物、二氧化硫的处理与利用是一项重要的热点课题.
Ⅰ![]() 经催化加氢可合成低碳烯烃:
经催化加氢可合成低碳烯烃:![]() 在
在![]() 时,按
时,按![]() :
:![]() :3投料,图1所示不同温度
:3投料,图1所示不同温度![]() 下,平衡时的四种气态物质的物质的量
下,平衡时的四种气态物质的物质的量![]() 的关系.
的关系.
![]() 该反应的
该反应的![]() ______
______ ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() .
.
![]() 曲线b表示的物质为 ______ .
曲线b表示的物质为 ______ .
![]() 为提高
为提高![]() 的平衡转化率,除改变温度外,还可采取的措施是 ______ .
的平衡转化率,除改变温度外,还可采取的措施是 ______ .
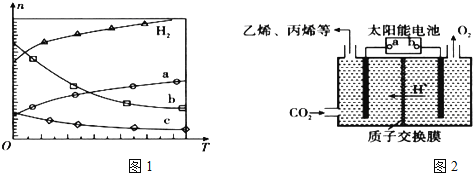
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解![]() 可得到多种燃料,其原理如图2所示.
可得到多种燃料,其原理如图2所示.
b为电源的 ______ 极,电解时,生成乙烯的电极反应式是 ______ .
Ⅱ![]() (3)用活性炭还原法可以处理氮氧化物.如反应:
(3)用活性炭还原法可以处理氮氧化物.如反应:![]()
![]() . 在
. 在![]() 时,反应进行到不同时间测得各物质的浓度如下:
时,反应进行到不同时间测得各物质的浓度如下:
时间 浓度 | 0 | 10 | 20 | 30 | 40 | 50 |
NO |
|
|
|
|
|
|
| 0 |
|
|
|
|
|
| 0 |
|
|
|
|
|
![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() ______ .
______ .
![]() 后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 ______
后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 ______ ![]() 答一种即可
答一种即可![]() .
.
Ⅲ.(4)工业上可以用NaOH溶液或氨水吸收过量的![]() ,分别生成
,分别生成![]() 、
、![]() ,其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中
,其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中![]() 较小的是 ______ ,用文字和化学用语解释原因 ______ .
较小的是 ______ ,用文字和化学用语解释原因 ______ .
【答案】![]()
![]() 加压
加压![]() 或不断分离出水
或不断分离出水![]() 正
正 ![]()
![]() 通入一定量的NO;适当缩小容器的体积、增大压强、通入等物质的量的
通入一定量的NO;适当缩小容器的体积、增大压强、通入等物质的量的![]() 和
和![]()
![]()
![]() ,
,![]() 水解使
水解使![]() 增大,电离平衡逆向移动,
增大,电离平衡逆向移动,![]() 浓度减小
浓度减小
【解析】
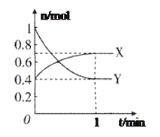
![]() 由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热;可知a为
由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热;可知a为![]() 的变化曲线,结合计量数关系可知b为水,c为
的变化曲线,结合计量数关系可知b为水,c为![]() 的变化曲线;
的变化曲线;
![]() 太阳能电池为电源,电解强酸性的二氧化碳水溶液得到乙烯,乙烯在阴极生成.据此解答;
太阳能电池为电源,电解强酸性的二氧化碳水溶液得到乙烯,乙烯在阴极生成.据此解答;
![]() 时,由表格数据可知20min达到平衡,平衡浓度
时,由表格数据可知20min达到平衡,平衡浓度![]() 、
、![]() 、
、![]() ,以此计算反应的平衡常数;
,以此计算反应的平衡常数;
![]() 后,只改变某一条件,反应重新达到平衡,
后,只改变某一条件,反应重新达到平衡,![]() ,由图表数据分析,平衡状态物质浓度增大,平衡常数
,由图表数据分析,平衡状态物质浓度增大,平衡常数![]() ,平衡常数不变,则结合浓度增大的影响因素来解答;
,平衡常数不变,则结合浓度增大的影响因素来解答;
![]() 根据铵根水解呈酸性,抑制亚硫酸氢根的电离比较同浓度的两种酸式盐的水溶液中
根据铵根水解呈酸性,抑制亚硫酸氢根的电离比较同浓度的两种酸式盐的水溶液中![]() 的浓度。
的浓度。
![]() 由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,
由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,
故答案为:![]() ;
;
![]() 随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线为
随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线为![]() ,由计量数关系可知b为水,c为
,由计量数关系可知b为水,c为![]() 的变化曲线,
的变化曲线,
故答案为:![]() ;
;
![]() 为提高
为提高![]() 的平衡转化率,除改变温度外,还可采取的措施是增大压强,
的平衡转化率,除改变温度外,还可采取的措施是增大压强,
故答案为:加压![]() 或不断分离出水
或不断分离出水![]() ;
;
![]() 电解时,二氧化碳在b极上生成乙烯,得到电子的一极为电源的正极,电极反应式为
电解时,二氧化碳在b极上生成乙烯,得到电子的一极为电源的正极,电极反应式为![]() ,
,
故答案为:正;![]() ;
;
![]() 时,由表格数据可知20min达到平衡,平衡浓度
时,由表格数据可知20min达到平衡,平衡浓度![]() 、
、![]() 、
、![]() ,则
,则![]() ,
,
故答案为:![]() ;
;
![]() 后,只改变某一条件,反应重新达到平衡,
后,只改变某一条件,反应重新达到平衡,![]() ,由图表数据分析,平衡状态物质浓度增大,平衡常数
,由图表数据分析,平衡状态物质浓度增大,平衡常数![]() ,平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;由氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,则改变的条件可能是通入一定量的NO或适当缩小容器的体积或增大压强或通入等物质的量的
,平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;由氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,则改变的条件可能是通入一定量的NO或适当缩小容器的体积或增大压强或通入等物质的量的![]() 和
和![]() ,
,
故答案为:通入一定量的NO或适当缩小容器的体积或增大压强或通入等物质的量的![]() 和
和![]() .
.
![]() 因为
因为![]() ,生成亚硫酸根离子,铵根水解呈酸性,抑制亚硫酸氢根的电离,所以
,生成亚硫酸根离子,铵根水解呈酸性,抑制亚硫酸氢根的电离,所以![]() 中
中![]() 浓度减小,
浓度减小,
故答案为:![]() ;
;![]() ,
,![]() 水解使
水解使![]() 增大,电离平衡逆向移动,
增大,电离平衡逆向移动,![]() 浓度减小.
浓度减小.

【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
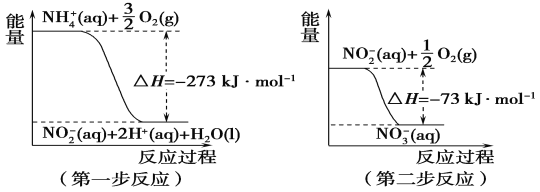
①第一步反应是________(填“放热”或“吸热”)反应。
②1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式:__________________。
(2)在298 K、101 kPa时,已知:2H2O(g)=O2(g)+2H2(g) ΔH1;
Cl2(g)+H2(g)=2HCl(g) ΔH2;
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3。
则ΔH3与ΔH1和ΔH2之间的关系正确的是___________。
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
(3)已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;ΔH1和ΔH2的关系是ΔH1_________ΔH2(填“>”、“<”或“=”)。
(4)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ/mol,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=________。