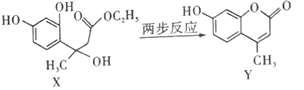
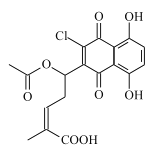
题目内容
【题目】下列表示对应化学反应的离子方程式正确的是
A.碳酸钙溶于醋酸:CaCO3 + 2H+ = Ca2++ CO2↑+H2O
B.铅蓄电池正极反应式:PbO2 + 2e- + 4H+ + SO![]() = PbSO4↓ + 2H2O
= PbSO4↓ + 2H2O
C.用铜做电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+
D.Na2CO3溶液水解:CO![]() + 2H2O
+ 2H2O![]() H2CO3 +2OH-
H2CO3 +2OH-
【答案】B
【解析】
A. 碳酸钙溶于醋酸,醋酸是弱酸,不能拆为离子形式,A不正确;
B.铅蓄电池正极中,PbO2得2e-转变为二价铅离子,与电解质溶液中的硫酸根结合为PbSO4,而氧离子与氢离子结合为水,故正极反应式为: PbO2+ 2e-+ 4H++ SO![]() == PbSO4↓ + 2H2O,B正确;
== PbSO4↓ + 2H2O,B正确;
C.用铜做电极电解CuSO4溶液时,铜为活性电极,要参与阳极反应,生成铜离子,不产生氧气,C不正确;
D.Na2CO3溶液水解时,碳酸根的水解要分步进行,水解方程式要分步写,不能一步生成H2CO3,D不正解。
答案选B。

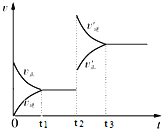
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
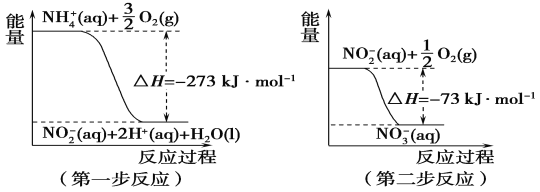
①第一步反应是________(填“放热”或“吸热”)反应。
②1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式:__________________。
(2)在298 K、101 kPa时,已知:2H2O(g)=O2(g)+2H2(g) ΔH1;
Cl2(g)+H2(g)=2HCl(g) ΔH2;
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3。
则ΔH3与ΔH1和ΔH2之间的关系正确的是___________。
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
(3)已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;ΔH1和ΔH2的关系是ΔH1_________ΔH2(填“>”、“<”或“=”)。
(4)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ/mol,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=________。