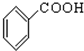
题目内容
18.(1)由金红石(TiO2)制取单质Ti涉及的步骤为:TiO2→TiCl4镁/800℃/Ar→镁/800℃/Ar→Ti.已知:①C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1
③TiO2(s)+2Cl2(g)?TiCl4(s)+O2(g)△H3=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)?TiCl4(s)+2CO(g)的△H=-80KJ/mol.
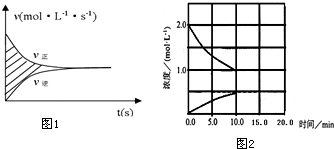
(2)在一定温度下,5L密闭容器中进行
TiO2(s)+2Cl2(g)+2C(s)?TiCl4(s)+2CO(g)反应,若容器中加入足量的TiO2和C后,充入0.2mol的Cl2,经过5s达到平衡时Cl2转化率为80%.
①计算v(CO)=6.4×10-3mol/(L•s),此温度下的平衡常数K=16.
②用Cl2的物质的量浓度的改变来表示反应速率v正、v逆与时间的关系图,则图1中阴影部分的面积为0.032mol/L.
③以下各项不能说明该反应达到平衡状态的是BE
A.气体的密度不随时间改变
B.容器中的压强不随时间变化
C.CO的浓度不随时间变化
D.TiCl4物质的量不随时间变化
E.TiCl4与CO物质的量之比不随时间变化
④若继续充入0.2molCl2,重新达到平衡后Cl2的浓度为0.032mol/Lmol/L.
(3)反应③经过10min达到平衡,得到物质的量浓度与时间的关系如图2.若将容器的容积压缩为原来的一半,再经过5min后重新达到平衡时的平衡常数为0.5,若升高温度该反应的平衡常数将增大(填:增大、减小或不变).
分析 (1)利用盖斯定律分析,根据待求的热化学方程式调整已知的热化学方程式,让已知的热化学方程式进行加和得到待求的热化学方程式,焓变也进行相应的加和;
(2)①基本模式--“三段式”,已知Cl2的初始浓度且已知转化率,得Cl2的变化浓度,根据浓度变化之比等于化学计量系数之比,求出CO的变化浓度,可求出其速率.
已知初始浓度、变化浓度就可以求出平衡浓度,带入平衡常数表达式即可(注意固体和纯液体不列入平衡常数表达式);
②阴影部分的面积为到达平衡时CO物质的量浓度的增加量为0.032mol/L;
③直接判断标志:等:ν正=ν逆,定:各组分的量均不再发生改变;
间接判断标志:密度、压强、平均摩尔质量----“变”量“不变”表征平衡;
④结合平衡常数计算;
(3)化学平衡常数的外界因素只与温度有关,故改变压强化学平衡常数不变;
若改变温度,根据同吸异放的规律,该反应为吸热反应,升高温度,平衡常数增大.
解答 解:(1)利用盖斯定律分析,根据待求的热化学方程式调整已知的热化学方程式,让已知的热化学方程式进行加和得到待求的热化学方程式,焓变也进行相应的加和,③+①×2-②,则△H=141+(-393.5)×2-(-566)=-80KJ/mol,
故答案为:-80KJ/mol;
(2)①TiO2(s)+2Cl2(g)+2C(s)?TiCl4(s)+2CO(g)
起始:0.04mol/L 0mol/L
转化:0.04mol/L×80%=0.032mol/L 0.032mol/l
平衡:0.008mol/L 0.032mol/L
v(CO)=△C△T△C△T=0.032mol/l5s0.032mol/l5s=6.4×10-3mol/(L•s),
K=[CO]2[Cl2]2[CO]2[Cl2]2=(0.032mol/L)2(0.008mol/L)2(0.032mol/L)2(0.008mol/L)2=16,
故答案为:6.4×10-3;16;
②图中aodb和bod围成的面积大小在数值上分别等于正反应CO浓度的增加量和逆反应CO浓度的减少量,由此可见
阴影部分的面积为到达平衡时CO物质的量浓度的净增加量为0.032mol/L,
故答案为:0.032mol/L;
③A.据ρ=mvmv,该反应反应前后不全部为气体,气体的总质量为变值,容器的体积V为定值,则ρ为变值,当变值不变了可以表征平衡了,A不选;
B.容器的压强与气体总的物质的量成正比,该反应前后气体的物质的量不变,容器的压强始终为定值,不能表征平衡,B选;
C.CO的浓度不变,说明体系中各组分的量均不再发生改变,说明达到平衡,C不选;
D.TiCl4虽然为固体,在一定的温度下,其物质的量浓度为定值,但是其物质的量是变,TiCl4物质的量不随时间变化,说明达到平衡,D不选;
E.若TiCl4与CO初始物质的量之比等于化学计量系数之比,不管平衡不平衡,TiCl4与CO物质的量之比始终不随时间变化,不能说明平衡,E选.
故答案为:BE;
④TiO2(s)+2Cl2(g)+2C(s)?TiCl4(s)+2CO(g)
起始:(0.04+0.008)mol/L 0.032mol/L
转化:x x
平衡:(0.048-x)mol/L ( 0.032+x)mol/L
温度不变的前提下,平衡常数K值不变,K=16=(0.032+x)2(0.048−x)2(0.032+x)2(0.048−x)2,得x=0.016mol/L
重新达到平衡后Cl2的浓度为0.048-0.016=0.032mol/L,
故答案为:0.032mol/L;
(3)TiO2(s)+2Cl2(g)?TiCl4(s)+O2(g)
平衡:1.0mol/L 0.5mol/L
k=0.510.51=0.5,
若改变温度,根据同吸异放的规律,该反应为吸热反应,升高温度,平衡常数增大;
故答案为:0.5; 增大.
点评 该题目考查盖斯定律焓变的计算;考查化学平衡计算--“三段式”及相关的转化率的计算、化学平衡常数的计算;考查化学平衡状态的判断标志(特别是D选项易错点);考查化学平衡常数外界因素只与温度有关.该题目考察面广,热点、考点集中全面.

| A. | 过渡元素 | B. | 稀有气体 | C. | 主族元素 | D. | 卤族元素 |
| A. | 锂 | B. | 铍 | C. | 氧 | D. | 钙 |
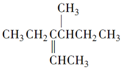 的命名正确的是( )
的命名正确的是( )| A. | 3-异丁基-2-戊烷 | B. | 4-甲基-3-乙基-2-己烯 | ||
| C. | 3-甲基-4-丙烯基己烷 | D. | 2,3-二乙基-3-戊烯 |
| A. | 体积减半,则压强为原来的两倍 | |
| B. | 平衡向右移动,混合气体的颜色一定会变浅 | |
| C. | 体积减半,压强增大,但小于原来的2倍 | |
| D. | 体积减半,压强增大,且大于原来的2倍 |
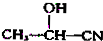
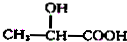
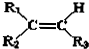
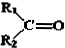 +
+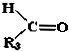
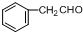 .现有如下转化关系:
.现有如下转化关系: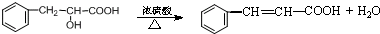 ;反应类型为消去反应;
;反应类型为消去反应;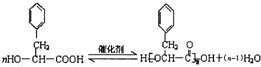 ;
;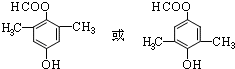 .
.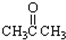 ③CH3CH2Br④
③CH3CH2Br④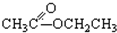 ⑤
⑤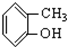 ⑥
⑥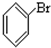 ⑦
⑦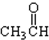 ⑧
⑧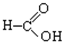 ⑨
⑨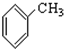 (10))
(10))